Биология клетки/Часть 1. Клетка как она есть/2/1
| Глава 2.1 | Следующая глава → | |
| Атомы | ||
Атом — наименьшая частица химического элемента
[править]
А́том (др.-греч. ἄτομος — неделимый) — наименьшая частица химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и электрически нейтральных нейтронов, а окружающее его облако состоит из отрицательно заряженных электронов.
Поскольку число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. Атом, который отдал или приобрел электроны, обладает некоторым положительным или отрицательным зарядом и называется ионом (ион может представлять собой и группу атомов — часть молекулы).
Атомы классифицируются по числу протонов и нейтронов в ядре: число протонов определяет принадлежность атома некоторому химическому элементу. Число нейтронов у атомов одного химического элемента может различаться, атомы с одинаковым числом протонов, но разным числом нейтронов называют изотопами данного элемента.
Атомы, связанные межатомными связями, образуют молекулы.
Модели атомов
В разные эпохи предлагались различные модели атомов, наиболее известная из которых — планетарная модель атома Бора-Резерфорда. В 1911 году Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а следовательно, терять энергию. Расчеты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает («модель атома Бора-Резерфорда»). Постулаты Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
Современные представления об атоме
Сегодня общепринятой является модель атома, являющаяся развитием планетарной модели. Считается, что ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами.
Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются c помощью квантовой механикой. Положение атома в таблице Менделеева определяется числом протонов, в то время как число нейтронов принципиально на химические свойства не влияет; при этом нейтронов в ядре, как правило, не меньше, чем протонов (см. атомное ядро). Если атом находится в нейтральном состоянии, то число электронов в нём равно числу протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
Массу атома принято измерять в атомных единицах массы, равных 1/12 от массы атома стабильного изотопа углерода 12C.
Атомы состоят из субатомных частиц
[править]Хотя слово атом в первоначальном значении обозначало частицу, которая не делится на меньшие части, согласно современным представлениям он состоит из более мелких частиц, называемых субатомными частицами. Атом состоит из электронов, протонов, все атомы, кроме водорода-1, содержат также нейтроны.
Электрон является самой лёгкой из составляющих атом частиц с массой 9,11 х 10−28 г, отрицательным зарядом и размером, слишком малым для измерения современными методами. Протоны обладают положительным зарядом и в 1836 раз тяжелее электрона (1,6726 х 10−24 г). Нейтроны не обладают электрическим зарядом и в 1839 раз тяжелее электрона (1,6929 х 10−24 г).
При этом масса ядра меньше суммы масс составляющих её протонов и нейтронов из-за эффекта дефекта массы. Нейтроны и протоны имеют сравнимый размер, около 2,5 х 10−15 м, хотя размеры этих частиц определены плохо.
В стандартной модели элементарных частиц как протоны, так и нейтроны состоят из элементарных частиц, называемых кварками. Наряду с лептонами, кварки являются одной из основных составляющих материи. И первые и вторые являются фермионами. Существует шесть типов кварков, каждый из которых имеет дробный электрический заряд, равный +2/3 или −1/3 элементарного. Протоны состоят из двух u-кварков и одного d-кварка, а нейтрон — из одного u-кварка и двух d-кварков. Это различие объясняет разницу в массах и зарядах протона и нейтрона. Кварки связаны между собой сильными ядерными взаимодействиями, которые передаются глюонами.
Размер атомов в миллионы раз меньше размеров клеток
[править]Атомы не имеют отчётливо выраженной внешней границы, поэтому их размеры часто определяют по расстоянию между ядрами соседних атомов, которые образовали химическую связь. Половина этого расстояния — радиус атома.
Есть и другой вариант определения радиуса атома (см. статью Размер атомов).
В периодической системе элементов размер атома увеличивается при движении сверху вниз по столбцу и уменьшается при движении по строке слева направо. Соответственно, самый маленький атом — это атом гелия, имеющий радиус 32 пм, а самый большой — атом цезия (225 пм). Эти размеры в тысячи раз меньше длины волны видимого света (400—700 нм), поэтому атомы нельзя увидеть в оптический микроскоп. Однако отдельные атомы можно наблюдать (например, на поверхности металлов) с помощью сканирующего туннельного микроскопа. Диаметр ядра атома примерно в 100.000 раз меньше диаметра самого атома.
Радиус зависит от положения атома, его типа, вида химической связи, числа ближайших атомов (координационного числа) и квантово-механического свойства, известного как спин.
Малость атомов демонстрируют следующие примеры. Человеческий волос по толщине в миллион раз больше атома углерода. Толщина человеческого волоса примерно 105 нм, а 10 углеродных атомов, выстроенных в цепочку, по толщине составляют 1 нм. Одна капля воды содержит 2 x 10 21 атомов кислорода и в два раза больше атомов водорода. Если бы яблоко можно было увеличить до размеров Земли, то атомы достигли бы исходных размеров яблока.
Клетка мелкой бактерии имеет объем около 1 мкм³. Даже в такой мелкой клетке содержится несколько миллионов атомов.
Электронные орбитали и энергетические уровни
[править]См. статью Атомная орбиталь См. статью Энергетический уровень
Когда электрон находится в связанном состоянии в атоме, он обладает потенциальной энергией, которая обратно пропорциональна его расстоянию от ядра. Эта энергия обычно измеряется в электронвольтах (эВ) и равна энергии, которую надо передать электрону, чтобы сделать его свободным (оторвать от атома). Согласно квантовомеханической модели атома связанный электрон может занимать только дискретный набор разрешённых энергетических уровней — состояний с определённой энергией. Наинизшее из разрешённых энергетических состояний называется основным, а все остальные — возбуждёнными.
Для перехода электрона с одного энергетического уровня на другой нужно передать ему или отнять у него энергию. Это происходит путём соответственно поглощения или испускания фотона, причём энергия этого фотона равна абсолютной величине разности энергий начального и конечного уровней электрона. Энергия испущенного фотона пропорциональна его частоте, поэтому переходы между разными энергетическими уровнями проявляются в различных областях электромагнитного спектра. Каждый элемент имеет уникальный спектр испускания, который зависит от заряда ядра, заполнения электронных подоболочек, взаимодействия электронов, а также других факторов.
Когда излучение с непрерывным спектром проходит через вещество (например, газ или плазму), некоторые фотоны поглощаются атомами или ионами, вызывая электронные переходы между энергетическим состояниями, разность энергий которых равна энергии поглощённого фотона. Затем эти возбуждённые электроны спонтанно переходят на уровень, лежащий ниже по энергии, снова испуская фотоны. Таким образом, вещество ведёт себя как фильтр, превращая исходный непрерывный спектр в спектр поглощения, в котором имеются серии тёмных полос. При наблюдении с тех углов, куда не направлено исходное излучение, можно заметить излучение с спектр испускания, излучаемого атомами. Спектроскопический анализ — измерения энергии, амплитуды и ширины спектральных линий излучения — позволяют определить вид излучающего вещества и физические условия в нём.
Электроны в атоме притягиваются к протонам, находящимся в ядре, под действием электромагнитных сил. Для того, чтобы электрон смог преодолеть притяжение ядра, ему необходимо передать энергию от внешнего источника. Чем ближе электрон находится к ядру, тем больше энергии для этого необходимо.
Электромагнитные силы удерживают электроны внутри потенциального барьера, окружающего ядро.
Электронам, как и другим субатомным частицам, свойственен корпускулярно-волновой дуализм — они представляют собой одновременно и частицу, и волну. В электронном облаке электронам соответствуют трёхмерные стоячие волны, не изменяющие своей формы с течением времени относительно ядра. Говорят, что электрон движется по орбитали. Существует дискретный набор таких орбиталей, и электроны могут находиться длительное время только в этих состояниях, так как они наиболее устойчивые.
На самом же деле это состояние описывают волновой функцией, квадрат которой характеризует плотность вероятности нахождения частицы в данной точке пространства в данный момент времени.
Каждой орбитали соответствует свой уровень энергии. Электрон может перейти на уровень с большей энергией (новую орбиталь), поглотив фотон — квант света. При этом он окажется в новом состоянии с большей энергией. Аналогично, он может перейти на уровень с меньшей энергией, излучив фотон. Энергия фотона при этом будет равна разности энергий электрона на этих уровнях (см. постулаты Бора).
Главное (радиальное) квантовое число — целое число, обозначающее номер энергетического уровня. Характеризует энергию электронов, занимающих данный энергетический уровень. Оно обозначается как . При увеличении главного квантового числа возрастают радиус орбитали и энергия электрона.
Наибольшее число электронов на энергетическом уровне, с учетом спина электрона, определяется по формуле , где N — число электронов на уровне, а n — главное квантовое число (номер уровня). Таким образом, на первом энергетическом уровне может находиться максимум 2 электрона, на втором — 8, на третьем — 18 и т. п. На каждом энергетическом уровне орбиталей вдвое меньше, чем электронов (1 орбиталь на первом уровне, 3 — на втором, 9 — на третьем). На каждой орбитали может находиться максимум по два электрона, отличающихся спином. Участвуют в образовании химических связей и определяют химические свойства атомов данного химического элемента почти исключительно электроны внешнего (самого далекого от ядра) электронного уровня.
Главное квантовое число является первым в ряду квантовых чисел, который включает в себя главное, орбитальное и магнитное квантовые числа, а также спин. Эти четыре квантовые числа определяют уникальное состояние электрона в атоме (его волновую функцию).
При увеличении номера элемента (числа протонов в ядре) растёт и число электронов. В какой последовательности они занимают электронные орбитали? Оказывается, чем меньше энергия данной орбитали, тем «быстрее» она заполняется электронами. Если же есть несколько орбиталей с равными энергиями, то электроны «стремятся» располагаться на них поодиночке, если есть такая возможность.
Электронная оболочка атома — область пространства вероятного местонахождения электронов, характеризующихся одинаковым значением главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях. Каждая электронная оболочка может иметь определённое максимальное число электронов.
Электронные оболочки обозначаются буквами s, p, d, f, g или цифрами от 0 до 4. Электроны внешних оболочек обладают большей энергией, и, по сравнению с электронами внутренних оболочек, находятся дальше от ядра, что делает их более важными в анализе поведения атома в химических реакциях и в роли проводника, так как их связь с ядром слабее и легче разрывается.
Подуровни оболочек
Каждая оболочка состоит из одного или нескольких подуровней, каждый из которых состоит из атомных орбиталей. К примеру, первая оболочка (K) состоит из одного подуровня «1s». Вторая оболочка (L) состоит из двух подуровней, 2s и 2p. Третья оболочка — из «3s», «3p» и «3d». Возможные варианты подуровней оболочек приведены в следующей таблице:
| Обозначение подуровня | l | Макс. кол-во электронов | Содержание в оболочках | Историческое наименование |
|---|---|---|---|---|
| s | 0 | 2 | В каждой | sharp |
| p | 1 | 6 | Во всех, начиная со 2 | principal |
| d | 2 | 10 | Во всех, начиная с 3 | diffuse |
| f | 3 | 14 | Во всех, начиная с 4 | fundamental |
| g | 4 | 18 | Во всех, начиная с 5 | |
| h | 5 | 22 | Во всех, начиная с 6 | |
| i | 6 | 26 | Во всех, начиная с 7 |
Валентные оболочки
Валентная оболочка — самая внешняя оболочка атома. Электроны этой оболочки зачастую называют валентными электронами, так как в основном именно эти электроны определяют поведение атома в химических реакциях. При образовании химических связей атомы «стремятся» заполнить свои внешние валентные оболочки.
С точки зрения химической активности, наименее активными считаются атомы, в которых валентная оболочка окончательно заполнена (инертные газы). Наибольшей химической активностью обладают атомы, в которых валентная оболочка состоит всего из одного электрона (щелочные металлы), и атомы, в которых одного электрона не хватает для окончательного заполнения оболочки (галогены).
На самом деле всё немного сложнее. Поведение атома в химических реакциях определяют электроны, обладающие большей энергией, то есть те электроны, которые расположены дальше от ядра. Электроны внутренних подуровней оболочек имеют меньшую энергию, чем электроны внешних подуровней. Несмотря на то, что электроны подуровня оболочки 3d могут не принадлежать к т. н. валентной оболочке, они могут иметь энергию большую, чем электроны подуровня оболочки 4s, что делает их валентными электронами (см. Валентные электроны и валентность).
Чтобы показать повторяющиеся химические свойства химических элементов, их упорядочивают в виде периодической таблицы (таблицы Менделеева). Элементы с одинаковым числом валентных электронов формируют группу, которая изображается в таблице в виде столбца (движение по горизонтальному ряду соответствуют заполнению валентной оболочки электронами). Элементы, находящиеся в самом правом столбце таблицы, имеют полностью заполненную электронами внешнюю оболочку, поэтому они отличаются крайне низкой химической активностью и называются инертными, или благородными газами.
Порядок заполнения электронных оболочек
Порядок заполнения электроннных оболочек (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется правилом Хунда.
Для начала разберемся в заполнении двух первых энергетических уровней. На первом уровне всего одна орбиталь (1s), на которой могут располагаться максимум два электрона. Энергия этой орбитали у любого атома ниже, чем у всех остальных орбиталей, поэтому она всегда заполняется первой. На втором уровне имеется четыре орбитали — 2s, 2px, 2py и 2pz. Сначала целиком заполняется 2s орбиталь (ее энергия меньше, чем у 2p-орбиталей). Затем заполняются p-орбитали. У них энергия равная, поэтому сначала электроны располагаются на них поодиночке. Так, у элемента N 7 (азот) электронная формула, которая описывает распределение электронов по орбиталям, будет 1s2 2s2 2px1 2py1 2pz1. Это означает, что по два электрона находятся на двух s-орбиталях и по одному — на каждой из трех p-орбиталей (см.[[1]].
- Вопрос 1
- Какова электронная формула элемента №6 (углерода)?
- Вопрос 2
- Сколько валентных электронов у бора? У углерода?
По определению, любые два атома с одним и тем же числом протонов в их ядрах относятся к одному химическому элементу. Итак, химический элемент — это сорт атомов с определенным числом протонов в ядре.
На июнь 2009 года известно 117 химических элементов (с порядковыми номерами с 1 по 116 и 118), из них 94 обнаружены в природе (некоторые — лишь в следовых количествах), остальные 23 получены искусственно в результате ядерных реакций.
Первые 112 элементов имеют постоянные названия, остальные — временные. Открытие 112-го элемента (самый тяжелый из официальных) признано Международным союзом теоретической и прикладной химии (en:International Union for Pure and Applied Chemistry). Самый стабильный из известных изотопов данного элемента имеет период полураспада 34 секунды. На начало июня 2009 года носит неофициальное имя унунбий, был впервые синтезирован в феврале 1996 года на ускорителе тяжелых ионов в Институте тяжелых ионов (Gesellschaft für Schwerionenforschung, GSI) в Дармштадте, Германия (в результате бомбардировки свинцовой мишени ядрами цинка). Первооткрыватели имеют полгода, чтобы предложить новое официальное название для добавления в таблицу (ими уже предлагались Виксхаузий, Гельмгольций, Венусий, Фриший, Штрассманий и Гейзенбергий). В настоящее время известны трансурановые элементы с номерами 113—116 и 118, полученные в Объединенном институте ядерных исследований в Дубне, однако они официально пока не признаны.
Химические символы Символы химических элементов используются как сокращения для названия элементов. В качестве символа обычно берут начальную букву названия элемента и в случае необходимости добавляют следующую или одну из следующих. Обычно это начальные буквы латинских названий элементов: Cu — медь (cuprum), Ag — серебро (argentum), Fe — железо (ferrum), Au — золото (aurum), Hg — ртуть (hydrargirum).
Пока Вам необходимо запомнить символы следующих элементов:
- C — углерод
- H — водород
- O — кислород
- N — азот
- S — сера
- P — фосфор
- K — калий
- Ca — кальций
- Mg — магний
- Fe — железо
- Cl — хлор
Карточка химического элементавключает краткую информацию о его свойствах. На рисунке показана карточка рутения.
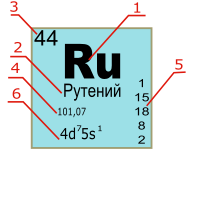
- 1 — обозначение химического элемента.
- 2 — русское название.
- 3 — порядковый номер химического элемента, равный количеству протонов в атоме.
- 4 — атомная масса.
- 5 — распределение электронов по энергетическим уровням.
- 6 — электронная конфигурация.
Атомы с одним и тем же количеством протонов, но разным количеством нейтронов называют изотопами данного элемента. Например, атомы водорода всегда содержат один протон, но существуют изотопы без нейтронов (водород-1, иногда также называемый протием — наиболее распространённая форма), с одним нейтроном (дейтерий) и двумя нейтронами (тритий).
Известные элементы составляют непрерывный натуральный ряд по числу протонов в ядре, начиная с атома водорода с одним протоном и заканчивая атомом унуноктия, в ядре которого 118 протонов.
Поскольку наибольший вклад в массу атома вносят протоны и нейтроны, полное число этих частиц называют массовым числом. Массу покоя атома часто выражают в атомных единицах массы (а. е. м.), которая также называется дальтоном (Да). Эта единица определяется как 1/12 часть массы покоя нейтрального атома обычного изотопа углерода — углерода-12, которая приблизительно равна 1,66 x 10−24 г. Масса атома приблизительно равна произведению массового числа на атомную единицу массы.
Водород-1 — наилегчайший изотоп водорода и атом с наименьшей массой, он имеет атомную массу около 1,007825 а. е. м.
Атомная масса химического элемента (также «средняя атомная масса», «стандартная атомная масса») является средневзвешенной атомной массой всех стабильных изотопов данного химического элемента с учётом их природной распространённости в земной коре и атмосфере. Например, хлор в природных соединениях находится в виде двух изотопов: 35Cl (75,5 % массы) и 37Cl (24,5 % массы). Среднюю атомную массу природного хлора равна 0,755∙35 + 0,245∙37 = 35,5
Именно эта атомная масса представлена в периодической таблице Д. И. Менделеева, её используют в стехиометрических расчётах.
Моль (единица количества вещества)
Так как массы даже самых тяжёлых атомов в обычных единицах (например, в граммах) очень малы, то в химии для измерения этих масс используют моли.
В одном моле любого вещества по определению содержится одно и тоже число атомов или иных частиц (молекул, ионов)— примерно 6,022×1023. Это число (число Авогадро) выбрано таким образом, что если масса элемента равна 1 а. е. м., то моль атомов этого элемента будет иметь массу 1 г. Например, углерод (точнее, изотоп углерод-12)имеет массу 12 а. е. м., поэтому 1 моль углерода весит 12 г.
Моль — одно из важнейших для химии понятий, и вот почему. Химические вещества вступают в химические реакции в определенных соотношениях, которые определяются их формулами. Например, при реакции горения водорода образуется вода. При этом в конечном продукте (Н2О) на каждый атом кислорода приходится два атома водорода. Значит, если мы хотим, чтобы исходные вещества целиком израсходовались в ходе реакции (ни одно из них не оказалось в избытке), на каждые два атома водорода нужно взять один атом кислорода. Но как это сделать? Нужно взять 1 моль кислорода и 2 моля водорода (или 0,1 моль кислорода и 0,2 моля водорода — важно соотношение 1:2). А это можно сделать, зная молекулярную массу кислорода O2(32 Да) и водорода H2(2 Да). Молекулярную массу легко перевести в молярную массу.
Моля́рная ма́сса вещества — масса одного моль вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента. В этом случае молярная масса элемента, выраженная в г/моль, численно совпадает с массой атома элемента, выраженной в а.е.м. (атомная единица массы). Однако надо четко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности.
Молярные массы сложных молекул можно определить, суммируя молярные массы входящих в них элементов. Например, молярная масса воды (H2O) есть MH2O = 2 MH +MO = 2·1+16 = 18 (г/моль).
- Вопрос 1
- Так сколько же грамм кислорода и водорода нужно взять, чтобы получить 96 г воды и чтобы при горении ни одно вещество не оказалось в избытке?
У каждого химического элемента есть один или более изотопов с нестабильными ядрами, которые подвержены радиоактивному распаду, в результате чего атомы испускают частицы или электромагнитное излучение. Радиоактивность возникает, когда радиус ядра больше радиуса действия сильных взаимодействий (расстояний порядка 1 фм.
Существуют три основные формы радиоактивного распада:
- Альфа-распад происходит, когда ядро испускает альфа-частицу — ядро атома гелия, состоящее из двух протонов и двух нейтронов. В результате испускания этой частицы возникает элемент с меньшим на два атомным номером.
- Бета-распад происходит из-за слабых взаимодействий, и в результате нейтрон превращается в протон или наоборот. В первом случае происходит испускание электрона и антинейтрино, во втором — испускание позитрона и нейтрино. Электрон и позитрон называют бета-частицами. Бета-распад увеличивает или уменьшает атомный номер на единицу.
- Гамма-излучение происходит из-за перехода ядра в состояние с более низкой энергией с испусканием электромагнитного излучения. Гамма-излучение может происходить вслед за испусканием альфа- или бета-частицы после радиоактивного распада.
Каждый радиоактивный изотоп характеризуется периодом полураспада, то есть временем, за которое распадается половина ядер образца. Количество оставшихся ядер уменьшается экспоненциально — вдвое за каждый период полураспада. Например, по прошествии двух периодов полураспада в образце останется только 25 % ядер исходного изотопа.
Радиоактивный распад играет важную роль в жизни организмов и в современных методах их исследования. Во-первых. разные виды ионизирующего излучения оказывают воздействие на все живые клетки, являются важным источником мутаций и других поверждений макромолекул. Во-вторых, метод меченых атомов (радиоизотопный метод) широко использщуется для исследования биохимических и молекулярно-биологических процессов, происходящих в клетках. В-третьих, в медицине (в особенности в онкологии) широко используются методы радиотерапии. Наконец, только с появлением радиоизотопного анализа появилась возможность определять абсолютный возраст горных пород, что играет важную роль в геологии и палеонтологии (см.[[2]]).


