Биология клетки/Часть 1. Клетка как она есть/2/16
| ← Предыдущая глава | Глава 2.16 | |
| Белки, их функции | ||
-Без белка жить можно,- сказал я,- а вот как он живет без потрохов?
-А вот товарищ Амперян говорит, что без белка жить нельзя,- сказал Витька, заставляя струю табачного дыма сворачиваться в смерч и ходить по комнате, огибая предметы.
-Я говорю, что жизнь- это белок,- возразил Эдик.
-Не ощущаю разницы,- сказал Витька.- Ты говоришь, что если нет белка, то нет и жизни.
А. и Б. Стругацкие «Понедельник начинается в субботу»
Мономеры белков — аминокислоты. Разнообразие и химические свойства аминокислот
[править]
Для синтеза белков используются двадцать стандартных аминокислот: именно они закодированы в ДНК триплетами генетического кода. Примечательно, что живые организмы используют в основном L-аминокислоты.
У некоторых организмов триплеты могут кодировать и «неканонические», нестандартные аминокислоты (например, селеноцистеин). Некоторые аминокислоты могут (обычно при участии ферментов) химически модифицироваться после синтеза белков, так что в составе «зрелых» белков обнаруживается более 20 разновидностей аминокислот.
Аминокислоты обычно присутствуют в растворах в виде цвиттер-ионов и являются амфолитами. Амфолитами называют молекулы, в структуре которых присутствуют как кислотные, так и основные группы, существующие в виде цвиттер-ионов при определённых значениях pH. Этот pH обозначается как изоэлектрическая точка молекулы.
Амфолиты образуют буферные растворы. Благодаря способности к выборочной ионизации они противодействуют изменению pH при добавлении кислоты или основания. В присутствии кислот они принимают на себя протоны, удаляя последние из раствора, и противодействуют повышению его кислотности. При добавлении оснований амфолиты высвобождают ионы водорода в раствор, препятствуя возрастанию pH, и тем сохраняя его равновесие.
[1] Физическиe и химичeскиe cвойства аминокислот
Функции аминокислот разнообразны
[править]Аминокислоты играют важнейшую роль в обмене веществ.
Кроме того, что аминокислоты служат мономерами для синтеза белков, они входят в состав некоторых небелковых веществ — муреина, некоторых антибиотиков и др. Глицин и глутаминовая кислота — важные нейромедиаторы.
Выделяют несколько уровней укладки белковых молекул
[править]Выделяют четыре основных уровня укладки белковых молекул (уровни структуры белка):
- Первичная структура — последовательность аминокислот в полипептидной цепи.
- Вторичная структура — локальное упорядочивание фрагментов полипептидной цепи, стабилизированное водородными связями и гидрофобными взаимодействиями.
- Третичная структура — пространственное строение полипептидной цепи; взаимное расположение элементов вторичной структуры, стабилизированное различными типами связей.
- Четверичная структура — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.

Первичная структура белка — последовательность аминокислот, соединенных пептидными связями
[править]
Молекулы белков представляют собой полимеры, состоящие из мономеров — α-L-аминокислот и, в некоторых случаях, из модифицированных аминокислот. По своей структуре белки — линейные нерегулярные гетерополимеры. Это означает, что полипептидные цепочки из аминокислот обычно не ветвятся и не образуют колец, в их состав входят разные мономеры, и они могут чередоваться в различной последовательности.
При образовании белка в результате взаимодействия α-аминогруппы (-NH2) одной аминокислоты с α-карбоксильной группой (-СООН) другой аминокислоты образуются пептидные связи. Концы белка называют С- и N-концом (в зависимости от того, какая из групп концевой аминокислоты свободна: -COOH или -NH2, соответственно). При синтезе белка на рибосоме новые аминокислоты присоединяются к C-концу, поэтому название пептида или белка даётся путём перечисления аминокислотных остатков начиная с N-конца.
Для обозначения аминокислот в научной литературе используются одно- или трёхбуквенные сокращения. На первый взгляд может показаться, что использование в большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие белков. На самом деле количество вариантов трудно переоценить: для цепочки всего из 5 аминокислот оно составляет уже более 3 миллионов, а цепочка из 100 аминокислот (небольшой белок) может быть представлена более чем в 10130 вариантах. Однако большинство вариантов не реализуются в природе, так как такие белки не смогли бы выполнять никаких функций.
Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, а более длинные — белками, хотя это деление весьма условно.
Вторичная структура белка — α-спирали и β-слои
[править]- Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями и гидрофильно-гидрофобными взаимодействиями. Две наиболее распространенные вторичные структуры -
α-спирали и β-листы (складчатые слои).
- α-спирали — плотные витки вокруг длинной оси молекулы. Один виток составляют 3,6 аминокислотных остатка, спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученные спирали.
Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина; близко расположенные остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остаток пролина вызывает изгиб цепи и также нарушает α-спирали.
- β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры R-групп аминокислот, преобладают обычно глицин и аланин.
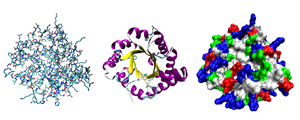
Образование третичной структуры. Глобулярные и фибриллярные белки. Связи, участвующие в формировании третичной структуры
[править]Кроме последовательности аминокислот полипептида (первичной структуры), крайне важна трёхмерная структура белка, которая формируется в процессе фолдинга (от англ. folding), «сворачивание»). Трёхмерная структура формируется в результате взаимодействия структур более низких уровней.
- Третичная структура — пространственное строение полипептидной цепи; взаимное расположение элементов вторичной структуры, стабилизированное различными типами взаимодействий. В стабилизации третичной структуры принимают участие:
- ковалентные связи между двумя остатками цистеина — дисульфидные мостики;
- ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
- водородные связи;
- гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные гидрофобные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Белки разделяют на две основные группы с разной трёхмерной структурой. Большинство белков — глобулярные: общая форма из молекулы более или менее сферическая. Меньшая часть белков фибриллярные: их молекулы (обычно и надмолекулярные комплексы) в работающем состоянии — вытянутые волокна. К фибриллярным белкам относятся, например, кератин и коллаген.
Среди глобулярных и фибриллярных белков выделяют подгруппы. Например, изображённый на картинке справа глобулярный белок фермент триозофосфатизомераза состоит из восьми α-спиралей, расположенных на внешней поверхности структуры, и восьми параллельных β-слоёв внутри структуры. Белки с подобным трёхмерным строением называются αβ-баррелы (от англ. barrel — бочка).
Четвертичная структура
[править]- Четверичная структура — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру (можно считать её и молекулой, если между разными полипептидными цепями, как это нередко бывает, образуются дисульфидные мостики). В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной.
Надмолекулярные белковые комплексы могут состоять из десятков молекул, многие из них сравнимы по размеру с рибосомами и в последние годы часто описываются как органоиды (см., напр., протеасома). Нередко в их состав входят молекулы РНК (см., напр., сплайсосома).
Постулат Полинга и принцип самосборки. Нарушения постулата Полинга
[править]Суть постулата Полинга заключается в том, что первичная структура белка (последовательность аминокислот) определяет вторичную, третичную и, наконец, четвертичную. Это означает, что все структуры белка, кроме первичной, детерминированы и полностью зависят от начальной последовательности аминокислот. Однако у этого принципа есть исключение - это белки прионы. Прион может существовать в двух конформациях — первая— PrPC, которую он имеет в нормальных клетках (в ней преобладают α-спирали) и «патологическая» — PrPSc (имеет β складчатую структуру). Белок PrPSc при попадании в здоровую клетку катализирует переход клеточного PrPC в патологическую конформацию, что в конечном итоге приводит к гибели клетки.
Белки как молекулярные машины
[править]Основные функции белков в клетке
[править]Запасающая (энергетическая) функция
[править]Белки редко используются как специальные запасные вещества. Вероятно, отчасти это связано с высокими энергозатратами, которые требуются для синтеза белка из аминокислот, а частично — с тем, что при «сжигании» белков в ходе катаболизма выделяются ядовитые «осколки» — аммиак, который в организме человека обезвреживается за счет превращения в менее токсичную мочевину.
Тем не менее, в яйцеклетках животных в состав желточных гранул входят белки в качестве запасных веществ (белок яйца — это белок, и желток — тоже белок!). Белки в значительных количествах запасаются в семенах семенных растений; особенно высокий процент их содержится в семенах бобовых. Питательную (энергетическую) функцию выполняют белки молока (казеин и др.).
Так как белки не полностью окисляются в ходе обмена веществ, при их использовании в организме выделяется всего около 4-4,1 ккал/г, а при полном окислении — сжигании в калориметре — около 5,6 ккал/г.
Структурная функция
[править]Структурная функция белков заключается в том, что белки
- участвуют в образовании практически всех органоидов клеток, во многом определяя их структуру (форму);
- образуют цитоскелет, придающий форму клеткам и многим органоидам и обеспечивающий механическую форму ряда тканей;
- входят в состав межклеточного вещества, во многом определяющего структуру тканей и форму тела животных.
Белки межклеточного вещества

В теле человека белков межклеточного вещества больше, чем всех остальных белков. Основными структурными белками межклеточного вещества являются фибриллярные белки.
Коллагены — семейство белков, входящих в состав межклеточного вещества. В теле человека составляют до 25 — 30 % общей массы всех белков. Кроме структурной функции коллаген выполняет также механическую, защитную, питательную и репаративную функции. Молекула коллагена представляет собой правозакрученную спираль из трёх α-цепей. Всего у человека имеется 28 типов коллагена. Все они сходны по структуре.
Эластин широко распространён в соединительной ткани, особенно в коже, легких и кровеносных сосудах. Общими характеристиками для эластина и коллагена являются большое содержание глицина и пролина. В эластине значительно больше валина и аланина и меньше глутаминовой кислоты и аргинина, чем в коллагене. В эластине содержатся десмозин и изодесмозин. Эти соединения можно обнаружить только в эластине. Эластин нерастворим в водных растворах (как и коллаген), в растворах солей, кислот и щелочей даже при нагревании. В эластине большое количество аминокислотных остатков с неполярными боковыми группами, что, по-видимому, обусловливает высокую эластичность его волокон.
Другие белки внеклеточного матрикса — ламинины, фибронектин и др. — выполняют как структурную, так и сигнальную функции. Взаимодействуя с мембранными рецепторами, они влияют на миграции клеток и другие стороны их поведения.
Белки цитоскелета. Один из основных структурных белков — кератин. В основном из кератина состоят мертвые клетки ороговевающего эпителия и их производные (волосы млекопитющих, рога, копыта, когти, перья птиц, чешуя рептилий и др.). В живых клетках эпителиальных тканей кератины образуют промежуточные филаменты.
Кератины разделяются на две группы: α-кератины и β-кератины. Прочность кератина уступает, пожалуй, только хитину. Характерной особенностью кератинов является их полная нерастворимость в воде при pH 7,0. Содержат в молекуле остатки всех аминокислот. Отличаются от других фибриллярных структурных белков (например, коллагена) в первую очередь повышенным содержанием остатков цистеина. Первичная структура полипептидных цепей a-кератинов не имеет периодичности.
В других типах тканей (кроме эпителиев) промежуточные филаменты образованы похожими на кератин по структуре белками — виментином, белками нейрофиламентов и др. Белки ламины в большинстве клеток эукариот образуют внутреннюю выстилку оболочки ядра. Состоящая из них ядерная ламина поддерживает ядерную мембрану и контактирует с хроматином и ядерными РНК.
Тубулин относится к филаментозным белкам. Димеры тубулина после полимеризации превращаются в нити (протофиламенты). Из них собираются микротрубочки, образующие цитоскелет, который помогает клетке поддерживать форму, обеспечивает связь между органеллами и выполняет ряд других функций.
Актин — тоже филаментозный белок. Из его мономеров при полимеризации образуются тонкие филаменты мышц и микрофиламенты немышечных клеток.
Хотя миозин обычно относят к моторным белкам, в мышечных клетках он входит в состав постоянных структур. В скелетных и сердечной мышцах миозин входит в состав саркомеров, образуя толстые филаменты.
К структурным относятся и многие вспомогательные белки, входящие в состав цитоскелета. Так, в образовании саркомеров участвуют белки титин, тропомиозин и др.
Структурные белки органелл
Белки создают и определяют форму (структуру) многих клеточных органелл. В основном из белков состоят такие органеллы, как рибосомы, протеасомы, ядерные поры и др. Гистоны необходимы для сборки и упаковки нитей ДНК в хромосомы. Из белков состоят клеточные стенки некоторых протистов (например, хламидомонады); в составе оболочки клеток многих бактерий и архей присутствует белковый слой (S-слой), который крепится у грамположительных видов к клеточной стенке, а у грамотрицательных — к наружной мембране. Из белка флагеллина состоят прокариотические жгутики.
Транспортная функция
[править]Транспортная функция белков — участие белков в переносе веществ в клетки и из клеток, в их перемещениях внутри клеток, а также в их транспорте кровью и другими жидкостями по организму.
Есть разные виды транспорта, которые осуществляются при помощи белков.
Перенос веществ через клеточную мембрану
У всех клеток есть мембрана, состоящая из двойного слоя липидов. В клетку должны поступать многие необходимые для жизни вещества (сахара, аминокислоты, ионы щелочных металлов), но мембрана для них непроницаема. Поэтому в состав мембраны входят транспортные белки, которые и осуществляют перенос всех необходимых соединений. Транспорт этих соединений осуществляют две группы белков:
1) белки-переносчики связываются с молекулой или ионом переносимого вещества и каким-либо способом доставляют её внутрь клетки.
2) каналообразующие белки образуют в мембране водные поры, через которые (когда они открыты) могут проходить вещества.
Каналообразующие белки коннексины и паннексины формируют щелевые контакты, через которые низкомолекулярные вещества могут транспортироваться из одной клетки в другую (через паннексины вещества могут проходить и в клетки из внешней среды).
Перенос веществ внутри клетки
Между ядром, другими органоидами и цитоплазмой клетки постоянно идет обмен разными веществами. Например, перенос белков между ядром и цитоплазмой (ядерно-цитоплазматический транспорт)происходит благодаря ядерным порам, которые пронизывают двухслойную оболочку ядра. Они состоят примерно из тридцати белков — нуклеопоринов. Вещества переносятся из цитоплазмы в ядро клетки вместе с беклами — транспортинами. Эти белки узнают вещества, предназначенные для транспорта в ядро, и связываются с ними. Затем этот комплекс белков заякоривается на белках ядерной поры и попадает в её канал, а затем в ядро. Там она связывается ещё с одним белком и распадается, а транспортины направляются обратно в цитоплазму.
Также для транспортировки веществ внутри клеток используются микротрубочки. По их поверхности могут передвигаться митохондрии и мембранные пузырьки. Этот транспорт осуществляют моторные белки. Они делятся на два типа: цитоплазматические динеины и кинезины. Эти две группы белков различаются тем, от какого конца микротрубочки они перемещают груз: динеины от + конца к — концу, а кинезины наоборот.
Перенос веществ по организму
Наиболее известный транспортный белок, транспортирующий вещества по организму — это гемоглобин. Он переносит кислород по кровеносной системе от лёгких к органам и тканям. Также 15 % углекислого газа транспортируется к лёгким с помощью гемоглобина. В скелетных и сердечной мышцах перенос кислорода выполняется белком миоглобином. Жирные кислоты транспортируются альбуминами сыворотки крови. Кроме того, белки группы альбуминов, например, транстиретин, транспортируют гормоны щитовидной железы. Также важнейшей транспортной функцией альбуминов является перенос билирубина, желчных кислот, стероидных гормонов, лекарств и неорганических ионов.
Другие белки крови — глобулины переносят различные гормоны, липиды и витамины. Транспорт ионов меди в организме осуществляет глобулин — церулоплазмин, а транспорт ионов железа — белок трансферрин.
Защитная функция
[править]Защитная функция белков — способность белков обеспечивать защиту организмов от неблагоприятного воздействия различных факторов. Эту функцию белки могут выполнять несколькими различными способами.
Механическая защита
Белки могут обеспечивать механическую защиту клетки или всего организма. Из белков состоит клеточная стенка некоторых протистов (например. одноклеточной водоросли хламидомонады), кутикула нематод и другие покровные образования. У наземных позвоночных ороговение покровного эпителия кожи обеспечивает белок кератин, синтезируемый в клетках эпидермиса. К роговых производных кожи относятся, роговые чешуи рептилий, перья и чехол клюва птиц, шерсть, копыта и рога млекопитающих и др. Состоящие из белков покровные образования могут обеспечивать не только механическую защиту, но и термоизоляцию, защиту от воздействия ультрафиолетового излучения и химических веществ, от потерь жидкости и проникновения в организм бактерий и других паразитов.
Свертывание крови
К механическим защитным функциям белков можно отнести способность крови свертываться, что обеспечивается благодаря белку фибриноген, содержащийся в плазме крови. Когда кровь начинает свертываться, фибриноген расщепляется ферментом тромбином; после расщепления образуется мономер — фибрин, который, в свою очередь, полимеризуется и образует длинные белые нити. Из нитей фибрина и эритроцитов образуется тромб, который при последующей сокращении фибрина затвердевает. Таким образом, фибрин играет главную роль в процессе свертывания крови и предотвращении кровопотери.
Химическая защита
Связывание токсинов белковыми молекулами и действие на токсины ферментов может обеспечивать их обезвреживание. Особенно важную роль в детоксикации у человека играют ферменты печени, расщепляющие яды или переводящие их в растворимую форму, что способствует их быстрому выведению из организма.
В защите клеток от вредных веществ могут принимать участие также транспортные белки, например, многие белки суперсемейства АВС-транспортеров. Эти белки, имеющиеся у всех живых организмов, транспортируют через клеточную мембрану различные вещества (липиды, многие ксенобиотики и др.). АВС-транспортеры обеспечивают защиту бактерий от действия многих антибиотиков, отвечают за явление множественной лекарственной устойчивости| раковых клеток.
Иммунная защита
Иммуная функция белков играет очень важную роль в организме животных. В тот момент, когда в организм попадают возбудители — вирусы или бактерии, в специализированных органах начинают вырабатываться специальные белки — антитела, которые связывают и обезвреживают возбудителей. Особенность иммунной системы заключается в том, что за счет антител она может бороться с почти любыми видами возбудителей.
В иммунной системе играют важную роль не только белки-антитела, но и лизоцимы и белки системы комплемента. Лизоцимы — белки-ферменты, которые разрушают стенки бактерий путем гидролизу их компонентов. Белки комплемента запускают каскад реакций, в результате которых образуется белок МАК (мембраноатакующий комплекс). МАК атакует бактерию, разрушая ее клеточную мембрану. Если этого не произошло, другие белки системы комплемента помечают эту клетку для последующего её уничтожения фагоцитами.
К защитным белкам иммунной системы относятся также интерфероны. Эти белки производят клетки, зараженные вирусами. Их воздействие на соседине клетки обеспечивает противовирусную устойчивость, блокируя в клетках-мишенях размножение вирусов или сборку вирусных частиц. Интерфероны обладают и иными механизмами действия, например, влияют на активность лимфоцитов и других клеток иммунной системы.
Защитная функция токсинов
Белки обеспечивают активную и пассивную ядовитость многих организмов, которая служит для защитыу от врагов или для нападения на добычу. Белки — основной компонент ядов большинства животных, а также некоторых грибов и бактерий. Попадая в организм жертвы, ядовитые белки (токсины) действуют на определенные молекулы или клетки-мишени. Мишенями для большинства токсинов служат клетки нервной системы.
Белки и пептиды содержатся в ядах большинства животных (например, змей, скорпионов, стрекающих и др.). Содержащиеся в ядах белки имеют различные механизмы действия. Так, яды гадюковых змей часто содержат фермент фосфолипазу, который вызывает разрушение клеточных мембран и, как следствие, гемолиз эритроцитов и геморрагию. В яде аспидов преобладают нейротоксины; например, в яде крайтов содержатся белки α-бунгаротоксин (блокатор никотиновых рецепторов ацетилхолина и β-бунгаротоксин(вызывает постоянное выделение ацетилхолина из нервных окончаний и тем самым истощение его запасов); совместное действие этих ядов вызывает смерть от паралича мышц.
Бактериальные белковые яды — ботулотоксин, токсин тетаноспазмин, вырабатываемый возбудителями столбняка, дифтерийный токсин возбудителя дифтерии, холерный токсин. Многие из них являются смесью нескольких белков с разных механизмом действия. Некоторые бактериальные токсины белковой природы являются очень сильными ядами; компоненты ботулотоксина — наиболее ядовитое из известных природных веществ.
Токсины патогенных бактерий рода Clostridium, видимо, требуются анаэробным бактериям для воздействия на весь организм в целом, чтобы привести его к смерти — это дает бактериям «безнаказанно» питаться и размножаться, а уже сильно увеличив свою популяцию покидать организм в виде спор.
Биологическое значение токсинов многих других бактерий точно не известно.
У растений в качестве ядов обычно используются вещества небелковой природы (алкалоиды, гликозиды и др.). Однако у растений встречаются и белковые токсины. Так, в семенах растения семейства молочайные клещевине содержится белковых токсин рицин. Этот токсин проинкает в цитоплазму клеток кишечника, и его ферментативная субъединица, воздействуя на рибосомы, необратимо блокирует трансляцию.
- [2] — Антитела
- [3] — Гемостаз (система свертывания крови)
- [4] — Интерфероны
- [5] — Бактериальные белковые токсины
- [6] — Механизм действия ботулотоксина (англ.)
- [[7]] — Яды животных
Двигательная функция
[править]Двигательные, или моторные белки способны использовать энергию гидролиза АТФ или энергию ионного градиента для совершения механической работы. К моторным белкам относятся, например, миозины, динеины и кинезины. Все эти белки относятся к АТФ-азам, так что они обладают и ферментативной функцией. Однако в изолированном виде они расщепляют лишь одну молекулу АТФ (на одну молекулу белка); образующаяся молекула АДФ остается связанной с белком и препятствует его работе. Расщеплять АТФ постоянно (циклически) они способны при взаимодействии с другими белками. Миозин расщепляет АТФ при взаимодействии с актином в составе микрофиламентов, а динеин и кинезин - при взаимодействии с тубулином в составе микротрубочек.
Рецепторная функция
[править]Многие белки выполняют функцию рецепторов. Слово «рецептор» в биологии употребляется в двух значениях. Рецепторами называются клетки, специализирующиеся на восприятии раздражителей. Это могут быть чувствительные нейроны или другие (не нервные) клетки (например, мышечные веретена).
Рецепторами также называются белки, молекулы которых служат для восприятия сигналов, получаемых клеткой, и запускают ответную реакцию клетки на тот или иной сигнал.
Белок-рецептор — молекула (обычно белок или гликопротеид)? распложеннная на поверхности клетки, клеточных органелл или растворенная в цитоплазме, специфически реагирующая изменением своей формы на присоединение к ней молекулы определенного химического вещества, передающего внешний регуляторный сигнал и, в свою очередь, передающая этот сигнал внутрь клетки или клеточной органеллы, нередко при помощи так называемых вторичных посредников или трансмембранных ионных токов.
Вещество, специфически соединяющееся с рецептором, называется лигандом этого рецептора. Внутри организма это обычно гормон или нейромедиатор либо их искусственные заменители, применяемые в качестве лекарственных средств и ядов (агонисты). Некоторые лиганды, напротив, блокируют рецепторы (антагонисты). Когда речь идет об органах чувств, лигандами являются вещества, воздействующие на рецепторы обоняния или вкуса. Кроме того зрительные рецепторы реагируют на свет, а в органах слуха и осязания рецепторы чувствительны к механическому давлению, вызываемому колебаниями воздуха и иными воздействиями.
Мембранные рецепторы
Очень часто у белков есть гидрофобные участки, которые взаимодействуют с липидами, и гидрофильные участки, которые находятся на поверхности мембраны клетки, соприкасаясь с водным содержимым клетки. Большинство мембранных рецепторов — именно такие трансмембранные белки.
Многие из мембранных белков-рецепторов связаны с углеводными цепями, то есть представляют собой гликопротеиды. На их внеклеточных поверхностях находятся олигосахаридные цепи (гликозильные группы), похожие на антенны. Такие цепочки, состоящие из нескольких моносахаридных остатков, имеют самые различные формы, что объясняется разнообразием связей между моносахаридными остатками и существованием α- и β-изомеров.
Функция «антенн» — это распознавание внешних сигналов. Распознающие участки двух соседних клеток могут обеспечивать сцепление клеток, связываясь друг с другом. Благодаря этому клетки ориентируются и создают ткани в процессе дифференцировки. Распознающие участки присутствуют и в некоторых молекулах, которые находятся в растворе, благодаря чему они избирательно поглощаются клетками, имеющими комплементарные распознающие участки (так, например, поглощаются ЛПНП с помощью рецепторов ЛПНП).
Два основных класса мембранных рецепторов — это метаботропные рецепторы и ионотропные рецепторы.
Ионотропные рецепторы представляют собой мембранные каналы, открываемые или закрываемые при связывании с лигандом. Возникающие при этом ионные токи вызывают изменения трансмембранной разности потенциалов и, вследствие этого, возбудимости клетки, а также меняют внутриклеточные концентрации ионов, что может вторично приводитъ к активации систем внутриклеточных посредников. Одним из наиболее полно изученных ионотропных рецепторов является н-холинорецептор.

Метаботропные рецепторы связаны с системами внутриклеточных посредников. Изменения их конформации при связывании с лигандом приводит к запуску каскада биохимических реакций, и, в конечном счете, изменению функционального состояния клетки. Основные типы мембранных рецепторов:
- Рецепторы, связанные с гетеротримерными G-белками (например, рецептор вазопрессина).
- Рецепторы, обладающие тирозинкиназной активностью (например, рецептор инсулина или рецептор эпидермального фактора роста).
Рецепторы, связанные с G-белками, представляют собой трансмембранные белки, имеющие 7 трансмембранных доменов, внеклеточный N-конец и внутриклеточный C-конец. Сайт связывания с лигандом находится на внеклеточных петлях, домен связывания с G-белком — вблизи C-конца в цитоплазме.
Активация рецептора приводит к тому, что его α-субъединица диссоциирует от βγ-субъединичного комплекса и таким образом активируется. После этого она либо активирует, либо, наоборот инактивирует фермент, продуцирующий вторичные посредники.
Рецепторы с тирозинкиназной активностью фосфорилируют последующие внутриклеточные белки, часто тоже являющиеся протеинкиназами, и таким образом передают сигнал внутрь клетки. По структуре это — трансмембранные белки с одним мембранным доменом. Как правило, в активированном состоянии они образуют гомодимеры, субъединицы которых связаны дисульфидными мостиками.
Внутриклеточные рецепторы
Внутриклеточные рецепторы — как правило, факторы транскрипции (например, рецепторы w:глюкокортикоидов) или белки, взаимодействующие с факторами транскрипции. Большинство внутриклеточных рецепторов связываются с лигандами в цитоплазме, переходят в активное состояние, транспортируются вместе с лигандом в ядро клетки, там связываются с ДНК и либо индуцируют, либо подавляют экспрессию некоторого гена или группы генов.
Особым механизмом действия обладает оксид азота (NO). Проникая через мембрану, этот гормон связывается с растворимой (цитозольной) гуанилатциклазой, которая одновременно является и рецептором оксида азота, и ферментом, который синтезирует вторичный посредник — цГМФ.
Сигнальная функция
[править]Сигнальная функция белков — способность белков служить сигнальными веществами, передавая сигналы между тканями, клетками или организмами.
Сигнальную функцию выполняют белки-гормоны. Связывание гормона с рецептором является сигналом, запускающим в клетке физиологические процессы. Гормоны регулируют концентрации веществ в крови и клетках, рост, размножение и другие процессы. Например, инсулин снижает содержание сахара в крови, гормон роста регулирует рост скелета, лептин регулирует аппетит.
Клетки могут взаимодействуют друг с другом на расстоянии с помощью сигнальных белков, передаваемых через межклеточное вещество. К таким белкам относятся цитокины, факторы роста и др.
Цитокины — небольшие пептидные информационные молекулы. Они регулируют взаимодействия между клетками, определяют жизнедеятельность клеток, их выживаемость, стимулируют или подавляют рост, дифференциацию, функциональную активность и апоптоз (явление программируемой клеточной смерти), обеспечивают согласованность и упорядоченность действий иммунной, эндокринной и нервной систем. Примером цитокинов может служить фактор некроза опухолей, который передаёт сигналы воспаления между клетками организма
Регуляторная функция
[править]Регуляторная функция белков ― осуществление белками регуляции процессов в клетке или в организме, что связано с их способностью к приему и передаче информации. Действие регуляторных белков обратимо и, как правило, требует присутствия лиганда. Постоянно открывают все новые и новые регуляторные белки, в настоящее время известна, вероятно, только малая их часть.
Существует несколько разновидностей белков, выполняющих регуляторную функцию:
- белки — рецепторы, воспринимающие сигнал (см. раздел "Рецепторная функция)
- сигнальные белки — гормоны и другие вещества, осуществляющие межклеточную сигнализацию (многие, хотя и далеко не все, из них является белками или пептидами) (см. раздел «Сигнальная функция»)
- регуляторные белки, которые регулируют многие процессы внутри клеток.
Белки регулируют процессы, происходщие внутри клеток, при помощи нескольких механизмов:
- взаимодействия с молекулами ДНК (транскрипционные факторы)
- при помощи фосфорилирования (протеинкиназы) или дефосфорилирования (протеинфосфатазы) других белков
- при помощи взаимодействия с рибосомой или молекулами РНК (факторы регуляции трансляции)
- воздействия на процесс удаления интронов (факторы регуляции сплайсинга)
Белки-регуляторы транскрипции
Транскрипционный фактор — это белок, который, попадая в ядро клетки, регулирует транскрипцию ДНК, то есть синтез мРНК по матрице ДНК. Некоторые транскрипционные факторы изменяют структуру хроматина, делая его более доступным для РНК-полимераз. Существуют различные вспомогательные транскрипционные факторы, которые создают нужную конформацию ДНК для последующего действия других транскрипционных факторов. Еще одна группа транскрипционных факторов — это те факторы, которые не связываются непосредственно с молекулами ДНК, а объединяются в более сложные комплексы с помощью белок-белковых взаимодействий.
Факторы регуляции трансляции
Трансляция — синтез полипептидных цепей белков по матрице мРНК, выполняемый рибосомами. Регуляция трансляции может осуществляться несколькими способами, в том числе и с помощью белков-репрессоров, которые связываются с мРНК. Известно много случаев, когда репрессором является белок, который кодируется этой мРНК. В этом случае происходит регуляция по типу обратной связи (примером этого может служить репрессия синтеза фермента треонил-тРНК-синтетазы).
Факторы регуляции сплайсинга
Внутри генов эукариот есть участки, не кодирующие аминокислот. Эти участки называются интронами. Они сначала переписываются на пре-мРНК при транскрипции, но затем вырезаются особым ферментом. Этот процесс удаления интронов, а затем последующее сшивание концов оставшихся участков называют сплайсингом (сшивание, сращивание). Существует альтернативный сплайсинг, при котором из одной пре-м-РНК могут образовываться несколько разных хрелых м-РНК. Сплайсинг осуществляется с помощью небольших РНК, обычно связанных с белками, которые называются факторами регуляции сплайсинга. В сплайсинге принимают участие белки, обладающие ферментативной активностью. Они придают пре-мРНК нужную конформацию. Для сборки комплекса(сплайсосомы) необходимо потребление энергии в виде расщепляемых молекул АТФ, поэтому в составе этого комплекса есть белки, обладающие АТФ-азной активностью.
Особенности сплайсинга определяются белками, способными связываться с молекулой РНК в областях интронов или участках на границе экзон-интрон. Эти белки могут препятствовать удалению одних интронов и в то же время способствовать вырезанию других. Направленная регуляция сплайсинга может иметь значительные биологические последствия. Например, у плодовой мушки дрозофилы альтернативный сплайсинг лежит в основе механизма определения пола.
Протеинкиназы и протеинфосфатазы
Важнейшую роль в регуляции внутриклеточных процессов играют протеинкиназы — ферменты, которые активируют или подавляют активность других белков путем присоединения к ним фосфатных групп.
Протеинкиназы регулируют активность других белков путем фосфорилирования — присоединения остатков фосфорной кислоты к остаткам аминокислот, имеющих гидроксильные группы. При фосфорилировании обычно изменяется функционирование данного белка, например, ферментативная активность, а также положение белка в клетке.
Существуют также протеинфосфатазы — белки, которые отщепляют фосфатные группы. Протеинкиназы и протеинфосфатазы регулируют обмен веществ, а также передачу сигналов внутри клетки. Фосфорилирование и дефосфорилирования белков — один из главных механизмов регуляции большинства внутриклеточных процессов.
Каталитическая функция белков. Обмен веществ и энергии как совокупность ферментативных реакций
[править]Ферменты, или энзи́мы (от лат. fermentum, греч. ζύμη, ἔνζυμον — дрожжи, закваска) — обычно белковые молекулы или молекулы РНК (рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых системах. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами. Белковые ферменты синтезируются на рибосомах, а РНК — в ядре.
Термины «фермент» и «энзим» давно используют как синонимы (первый в основном в русской и немецкой научной литературе, второй — в англо- и франкоязычной).
Наука о ферментах называется энзимологией.
Ферменты специфичны к субстратам (АТФаза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу).
Ферменты обычно проявляют высокую специфичность по отношению к своим субстратам (субстратная специфичность). Это достигается частичной комплементарностью формы, распределения зарядов и гидрофобных областей на молекуле субстрата и в центре связывания субстрата на ферменте. Ферменты обычно демонстрируют также высокий уровень стереоспецифичности (образуют в качестве продукта только один из возможных стереоизомеров или используют в качестве субстрата только один стереоизомер), региоселективности (ообразуют или разрывают химическую связь только в одном из возможных положений субстрата) и хемоселективности (катализируют только одну химическую реакцию из нескольких возможных для данных условий). Несмотря на общий высокий уровень специфичности, степень субстратной и реакционной специфичности ферментов может быть различной. Например, эндопептидаза трипсин разрывает пептидную связь только после аргинина или лизина, если за ними не следует пролин, а пепсин гораздо менее специфичен и может разрывать пептичную связь, следующую за многими аминокислотами.
Активность ферментов определяется их трёхмерной структурой. Как и все белки, ферменты синтезируются в виде линейной цепочки аминокислот, которая сворачивается определённым образом. Каждая последовательность аминокислот сворачивается особым образом, и получающаяся молекула (белковая глобула) обладает уникальными свойствами. Многие ферменты обладают сложной четвертичной структурой.
Механизм работы ферментов
Чтобы катализировать реакцию, фермент должен связаться с одним или несколькими субстратами. Белковая цепь фермента сворачивается таким образом, что на поверхности глобулы образуется щель, или впадина, где связываются субстраты. Эта область называется сайтом связывания субстрата. Обычно он совпадает с активным центром фермента или находится вблизи него. Некоторые ферменты содержат также сайты связывания кофакторов (коферментов, ионов металлов, АТФ и др.).
Фермент, соединяясь с субстратом:
- очищает субстрат от водяной «шубы»
- располагает реагирующие молекулы субстратов в пространстве нужным для протекания реакции образом
- подготавливает к реакции (например, поляризует) молекулы субстратов.
Обычно присоединение фермента к субстрату происходит за счет ионных или водородных связей, редко — за счет ковалентных. В конце реакции её продукт (или продукты) отделяются от фермента.

В результате фермент снижает энергию активации реакции. Это происходит потому, что в присутствии фермента реакция идет по другому пути (фактически происходит другая реакция), например:
В отсутствии фермента:
- А+В = АВ
В присутствии фермента:
- А+Ф = АФ
- АФ+В = АВФ
- АВФ = АВ+Ф
где А, В — субстраты, АВ — продукт реакции, Ф — фермент.
Модель «ключ-замок»

В 1890 г. Эмиль Фишер предположил, что специфичность ферментов определяется точным соответствием формы фермента и субстрата. Такое предположение называется моделью «ключ-замок». Фермент соединяется с субстратом с образованием короткоживущего фермент-субстратного комплекса. Однако, хотя эта модель объясняет высокую специфичность ферментов, она не объясняет явления стабилизации переходного состояния, которое наблюдается на практике.
Регуляция работы ферментов
[править]Ферментативная активность может регулироваться активаторами и ингибиторами ферментов (активаторы — повышают, ингибиторы — понижают).
- [8] Анимация «Снижение энергии активации: роль ферментов» (англ. текст)
