Биология клетки/Одностраничная версия
Биология клетки

Данная книга — разноуровневый учебник, рассчитанный на всех, кто интересуется клеточной биологией и общими проблемами биологии. В первую очередь он предназначен для школьников старших классов биологического профиля и студентов биологических факультетов ВУЗов.
Жирным шрифтом или крупными буквами выделен наиболее простой материал, обязательный для запоминания при изучении школьной программы или при подготовке в ВУЗ. Обычный шрифт — основная часть информации, часто необходимая для понимания того, что выделено жирным или крупным шрифтом. Мелкий шрифт — сведения из истории науки или другая информация, интересная лишь части читателей. Курсив — материал повышенной сложности, предназначенный в основном для студентов биологических специальностей или для тех, кто серьезно интересуется клеточной и молекулярной биологией.
Полезные сайты для пользователей данного учебника:
- Molecular Biology Of The Cell, 4е издание, 2002 г. — учебник по молекулярной биологии на английском языке
- Молекулярная биология клетки 2-е издание (без иллюстраций)
- Наглядная биохимия Ян Кольман, Клаус-Генрих Рем, Юрген Вирт
- Элементы: Популярный сайт о фундаментальной науке
- База знаний по биологии человека
- Проект «Cell Biology» в Wikiversity (на английском языке)
Часть 1. Клетка как она есть
[править]Введение
[править]Клетка — основа жизни
[править]Клетки — маленькие мешочки, окруженные очень тонкой жировой пленочкой и содержащие водный раствор нескольких тысяч разных молекул. Большинство организмов на Земле (по численности - наверняка, по биомассе - вероятно, а возможно, и по числу видов) — одноклеточные: их тела состоят из одного такого мешочка. Но и тела крупных организмов — белого гриба, сосны или человека — состоят из множества подобных мешочков. В организме человека их более 1013 — 10.000.000.000.000 штук! Как это ни удивительно, каждый из этих мешочков — живой. Он обладает всеми основными свойствами живого, в том числе главным из них — способен размножаться с сохранением наследственных свойств.
- Задание
- Прежде чем читать дальше, перечислите основные свойства живого. После выполнения задания — см. Основные научные проблемы биологии и их связь с изучением клеток
Благодаря каким своим свойствам клетка — живая? Поиски ответа на этот вопрос, выяснение деталей строения и работы клеток — одно из главных направлений работы современных биологов.
Уровни организации живого и система биологических наук
[править]Обычно выделяют четыре основных уровня организации живого
[править]Клетки, живые организмы и в целом жизнь на Земле представляют собой сложные системы. Для этих систем характерна иерархичность — одни системы входят в состав других (систем более высокого уровня) в качестве их подсистем. У более сложных систем высшего уровня появляются новые свойства, которые на предыдущем уровне отсутствуют. Кроме того, системы разного уровня имеют очень разные размеры: от нескольких нанометров (крупные молекулы и мелкие органоиды) до нескольких тысяч километров (крупные экосистемы и вся биосфера). Обычно выделяют четыре основных уровня организации -
- молекулярно-клеточный,
- организменный,
- популяционно-видовой,
- экосистемный.
- Вопрос 1
- Какие принципиально новые свойства появляются на каждом из четырех основных уровней организации?
Преимущество этого подхода — в том, что любая живая система «включена» во все эти уровни организации. Недостатки — прежде всего в том, что к каждому из этих уровней относятся системы принципиально разного уровня сложности. Даже клеточный уровень включает клетки прокариот и эукариот — а это как раз системы принципиально разного уровня сложности. Организменный же уровень включает и бактерий, и человека — системы, еще сильнее различающиеся по уровню сложности. Кроме того, до уровня вида все объекты этой классификации связаны генетически и представляют собой систему с единым генофондом. Экосистема, даже несмотря на наличие горизонтального переноса генов, такой системой не является. Эти недостатки побуждают многих авторов искать другие критерии выделения уровней организации — например, использовать длительность их существования (выделяя онтогенетический и филогенетический уровни).
- Вопрос 2
- Какие из основных уровней относятся к онтогентическому, а какие — к филогенетическому?
Часто (особенно в школьных учебниках и программах) предлагается выделять более дробные уровни:
- Молекулярный
- Субклеточный
- Клеточный
- Тканевой
- Органный
- Организменный
- Популяционно-видовой
- Биоценотический (экосистемный)
- Биосферный
Недостатки такого варианта еще более очевидны.
- Вопрос 3
- Какие недостатки вы видите в дробной иерархии уровней?
- Задание
- Попробуйте предложить свои критерии для выделения уровней организации и создать свою классификацию этих уровней.
Впрочем, иногда на вопрос "Какие бывают уровни организации живого?" от учащегося могут требовать и ответа вроде "Ядерный и доядерный". Под такую классификацию также могут попадать системы разной сложности, но на вышеупомянутом клеточно-молекулярном уровне все они будут обладать гораздо более схожими свойствами.
Особенности клеточного уровня
[править]Главная особенность клеточного уровня состоит в том, что только целая клетка имеет все основные признаки живого, причем не только потому, что клетка обладает всеми этими признаками, но и потому, что существуют популяции и виды одноклеточных организмов. Более того — недавно была открыта и экосистема, состоящая из единственного вида бактерий [1] [2][3]. С момента появления первых клеток жизнь, несомненно, уже существовала в виде экосистем, то есть начала приобретать современные геохимические функции.
Система биологических наук. Разделы биологии, изучающие клетку
[править]Сложность живых систем отражена в сложности биологии как науки и многообразии ее разделов. Во-первых, существуют частные науки, изучающие отдельные группы живых организмов — зоология, микология, ботаника, протистология, бактериология, вирусология. Нашим собственным видом занимается антропология.
Каждая из них делится на ряд ещё более частных разделов. Например, в зоологии выделяют энтомологию, орнитологию, ихтиологию и др., в ботанике — бриологию, альгологию (последняя наука, правда, может быть отнесена и к протистологии).
Другие биологические науки в основном связаны с определенными уровнями организации живого. Молекулярный уровень изучают биохимия, молекулярная биология, молекулярная генетика. По своим методам (а отчасти и по объекту изучения) близка к этим наукам вирусология.
Тесно связаны с ними и науки, изучающие клеточный уровень — цитология (клеточная биология), гистология, иммунология и др.
Организменный уровень изучают такие науки, как анатомия, физиология и эмбриология (биология развития). С этим уровнем тесно связаны и многие разделы генетики (например, генетика развития).
Популяционно-видовой уровень изучают популяционная генетика и популяционная экология. Кроме того, этим уровнем занимается эволюционная биология, так как на этом уровне организации происходят процессы микроэволюции. Этот же уровень — объект изучения систематики.
Экосистемный уровень — основной объект изучения большинства разделов экологии. К этому уровню смещаются в последние годы и интересы палеонтологов: всё большее внимание они уделяют не отдельным видам, а экосистемам былых геологических эпох. Наконец, одна из основных проблем современной эволюционной биологии — разработка теории эволюции экосистем.
Есть и науки, объект изучения которых — не уровень организации или группа организмов, а какой-то аспект свойств живого. К таким наукам можно отнести, например, биоинформатику и биофизику.
На первый взгляд, биологические науки очень резко различаются и сильно изолированы друг от друга. Например, биохимия по своим методам (а во многом и предмету изучения) — это почти что химия, а геоботаника — почти что география. Где и как могут встретиться и что будут обсуждать при встрече орнитолог и вирусолог? Так действительно и обстояло дело до недавнего времени. В настоящее врем взаимопроникновение биологических наук усиливается, всё чаще применяется междисциплинарный подход в биологических исследованиях. Всё чаще можно встретить словосочетания «экологическая генетика» [1]или «химическая экология» [4]. Метагеномика [5] обеспечила настоящий прорыв в изучении состава экосистем.
- Вопрос 4
- А действительно, где и как могут встретиться и что (с наибольшей вероятностью) будут обсуждать при встрече орнитолог и вирусолог? Попробуйте ответить на этот вопрос (допустим, что обсуждать они будут биологические проблемы, представляющие взаимный интерес, а не результаты чемпионата мира по футболу).
Редукционистский подход сыграл решающую роль в прогрессе биологии в XX веке
[править]За последние десятилетия наибольших успехов достигла молекулярная биология. Во многом эти успехи связаны с использованием принципа редукционизма. В применении к изучении клетки этот принцип состоит в том, что возможно объяснение сложных процессов в клетке и организме как результата простых химических реакций.
Законы физики и химии (часто имеющие вид запретов) выполняются в живой природе, так как живые организмы состоят из тех же атомов и полей, что и неживая природа. В основе жизнедеятельности клеток лежат химические реакции, а в основе жизнедеятельности и развития организма — работа клеток. Значит, понять работу организма можно, изучая химию. Можно изучить атомы, потом молекулы, химические реакции, в которых участвуют эти молекулы, и мы поймем, например, процесс пищеварения. Так во многих случаях и произошло. Оказалось, что очень многие биологические процессы можно описать «на языке» химии.
Редукционистский подход имеет границы применимости в биологии
[править]А можно ли понять, как человек думает, если изучить все химические процессы в отдельных нейронах — нервных клетках его мозга? Поможет ли изучение химических реакций понять, почему у жирафа для добывания листьев с деревьев служит длинная шея, а у слона — хобот? Или объяснить, почему численность насекомых в разные годы различается сильно, а птиц — слабо?
Вряд ли это возможно — ведь даже самый точный химический анализ отдельных деталей компьютера не поможет понять принцип его работы. Дело в том, что любая система, состоящая из нескольких элементов, может приобретать новые свойства. Свойства системы зависят не только от свойств элементов, но и от взаимосвязей между ними. Изучая отдельные элементы, мы не поймем принципов работы системы. Поэтому так важен для многих разделов биологии системный подход. Например, чтобы понять работу мозга человека, важно изучать не только отдельные молекулы или клетки, но и сложные взаимодействия между клетками мозга, взаимосвязи мозга с органами чувств и с другими системами органов.
[2] А. А. Любищев. Редукционизм и развитие морфологии и систематики. (Точка зрения авторов цитированных работ может не совпадать с точкой зрения авторов учебника).
Многие важнейшие научные проблемы биологии связаны с изучением клеток
[править]- Задание
К своему 125-летию журнал Science опубликовал список 125 важнейших научных проблем современности, из которых выделил 25 главных. Из этих 25 проблем 16 (!) перечисленных ниже имеют непосредственное отношение к биологии, а из этих 16-ти большинство связано с изучением клеточного уровня.
Важнейшие научные проблемы биологии по версии журнала Science ====
- 2. Каковы биологические основы сознания?
- 3. Почему у человека так мало генов? Как вся наследственная информация помещается в 20-25 тыс. генов, имеющихся в нашей ДНК?
- 4. Насколько индивидуальные генетические особенности человека важны для его лечения?
- 6. На сколько можно увеличить продолжительность жизни человека?
- 7. Как контролируется регенерация органов?
- 8. Как клетка кожи может превратиться в нервную клетку?
- 9. Как единственная соматическая клетка превращается в целое растение?
- 12. Когда и где зародилась земная жизнь?
- 13. Какие факторы среды определяют видовое разнообразие экосистем?
- 14. Какие генетические особенности делают человека человеком?
- 15. Как хранится в мозге и как извлекается хранящаяся информация?
- 16. Как возникло поведение, ориентированное на сотрудничество, и зачем в животном мире нужен альтруизм?
- 17. Как обрабатывать и обобщать большие массивы данных в биологии, и будет ли создана на этом пути «системная биология»?
- 20. Можно ли избирательно блокировать реакции иммунной системы?
- 22. Можно ли создать вакцину от СПИДа?
- 25. Можно ли при продолжающемся росте народонаселения достичь всеобщего благосостояния, не опустошив планету?
В голове у редакторов, которые составляли этот список, царила приличная каша. Попробуйте в ней разобраться, а именно
- назовите проблемы, которые, на ваш взгляд, уже полностью или в значительной степени решены;
- назовите проблемы, которые не являются научными (то есть не требуют новых научных открытий, теорий и обобщений), а являются чисто прикладными.
[3] Важнейшие научные проблемы по версии журнала Science]
На самом деле в число основных научных проблем биологии имеет смысл включать только проблемы фундаментальных, но не прикладных исследований. Очевидно, что фундаментальные научные проблемы тесно связаны с основными свойствами живого. Ниже мы сформулируем их, учитывая и те, которые в общих чертах уже решены.
Важнейшие научные проблемы биологии по версии учебника «Биология клетки»
[править]- Как происходит передача наследственных свойств при размножении?
- В целом эта проблема решена. Первый шаг к её решению сделал Грегор Иоганн Мендель, открывший в 1865 г основные законы наследования. Следующий шаг был сделан, когда в 1870-е-1890-е годы были описаны митоз, мейоз и оплодотворение. Ещё на шаг ученые приблизились к разгадке тайны наследственности, когда в 1910-е годы Томасом Гент Морганом и его сотрудниками была создана хромосомная теория наследственности. В 1920-е годы Николай Константинович Кольцов предсказал молекулярный механизм записи наследственной информации и разработал теорию матричного синтеза наследственных молекул. В 1940-е-1950-е годы было доказано, что молекулы наследственности действительно существуют и что это - молекулы ДНК. Наконец, решающий шаг был сделан в 1953 году, когда Джеймс Уотсон и Фрэнсис Крик создали модель двойной спирали ДНК и предсказали механизм её удвоения.
- Как линейная запись наследственной информации в виде генетического кода молекул ДНК превращается в сложную трехмерную организацию клеток и многоклеточных организмов? (проблема реализации наследственной информации).
- В целом эта проблема не решена и остается одной из главных проблем, которые пытается решить биология.
- Как происходит обмен веществ и энергии в клетках?
- В целом эта проблема решена в течение ХХ века.
- Как и под влиянием каких причин возникают изменения наследственной информации и в целом различия между организмами одного вида? (проблема природы изменчивости)
- В целом эта проблема решена.
- Как в ряду поколений происходят приспособительные изменения и возникают новые виды живых организмов? (проблема механизмов эволюции)
- В целом эта проблема решена Чарльзом Дарвином, который для объяснения механизмов эволюции предложил теорию естественного отбора. Однако детали процессов видообразования и появления новых признаков понятны далеко не полностью, и все время происходят открытия новых важных деталей механизмов эволюции.
- Как клетки и другие биосистемы воспринимают сигналы и в зависимости от условий меняют свою работу? (проблема регуляции)
- Хотя эта проблема решена в общих чертах, до более полного её решения ещё очень далеко. Отметим, что к этой области исследований относятся многие проблемы, перечисленные в списке журнала Science.
Клетка — основа жизни
[править]Клеточная теория — одно из главных научных обобщений в биологии
[править]Клеточная теория — основополагающая для общей биологии теория, сформулированная в середине XIX века. Она предоставила базу для понимания строения и развития организмов и для развития эволюционного учения. Маттиас Шлейден и Теодор Шванн сформулировали клеточную теорию, основываясь на множестве исследований о клетке (1838—1839). Рудольф Вирхов позднее (1858) дополнил её важнейшим положением (всякая клетка из клетки).
Шлейден и Шванн, обобщив имеющиеся знания о клетке, доказали, что клетка является основной единицей любого организма. Клетки животных, растений и бактерии имеют схожее строение. Позднее эти заключения стали основой для доказательства единства происхождения организмов. Т. Шванн и М. Шлейден ввели в науку основополагающее представление о клетке: вне клеток нет жизни.
История
[править]XVII век
В 1665 году английский физик Роберт Гук в работе «Микрография» описывает строение пробки, на тонких срезах которой он нашёл правильно расположенные пустоты. Эти пустоты Гук назвал «порами, или клетками». Наличие подобной структуры было известно ему и в некоторых других частях растений.
В 1670-е годы итальянский медик и натуралист М. Мальпиги и английский натуралист Н. Грю описали в разных органах растений «мешочки, или пузырьки» и показали широкое распространение у растений клеточного строения. Клетки изображал на своих рисунках голландский микроскопист А. Левенгук. Он же первым открыл мир одноклеточных организмов — описал бактерий и протистов (инфузорий).
Исследователи XVII века, показавшие распространённость «клеточного строения» растений, не оценили значение открытия клетки. Они представляли клетки в качестве пустот в непрерывной массе растительных тканей. Грю рассматривал стенки клеток как волокна, поэтому он ввёл термин «ткань», по аналогии с текстильной тканью. Исследования микроскопического строения органов животных носили случайный характер и не дали каких-либо знаний об их клеточном строении.
XVIII век
В XVIII веке совершаются первые попытки сопоставления микроструктуры клеток растений и животных. К. Ф. Вольф в работе «Теории зарождения» (1759) пытается сравнить развитие микроскопического строения растений и животных. По Вольфу, зародыш как у растений, так и у животных развивается из бесструктурного вещества, в котором движения создают каналы (сосуды) и пустоты (клетки). Фактические данные, приводившиеся Вольфом, были им ошибочно истолкованы и не прибавили новых знаний к тому, что было известно микроскопистам XVII века. Однако его теоретические представления в значительной мере предвосхитили идеи будущей клеточной теории.
Вероятно, первым ученым, который наблюдал деление клетки (у одноклеточных водорослей), был Авраам Трамбле.
XIX век
В первую четверть XIX века происходит значительное углубление представлений о клеточном строении растений, что связано с существенными улучшениями в конструкции микроскопа (в частности, с созданием ахроматических линз).
Линк и Молднхоуэр устанавливают наличие у растительных клеток самостоятельных стенок. Выясняется, что клетка есть некая морфологически обособленная структура. В 1831 году Моль доказывает, что даже такие, казалось бы, неклеточные структуры растений, как водоносные трубки, развиваются из клеток.
Мейен в «Фитотомии» (1830) описывает растительные клетки, которые «бывают или одиночными, так что каждая клетка представляет собой особый индивид, как это встречается у водорослей и грибов, или же, образуя более высоко организованные растения, они соединяются в более и менее значительные массы». Мейен подчёркивает самостоятельность обмена веществ каждой клетки.
В 1831 году Роберт Броун описывает ядро и высказывает предположение, что оно является постоянной составной частью растительной клетки.
Школа Пуркинье
В 1801 году Вигиа ввёл понятие о тканях животных, однако он выделял ткани на основании анатомического препарирования и не применял микроскопа. Развитие представлений о микроскопическом строении тканей животных связано прежде всего с исследованиями Яна Пуркинье, основавшего в Бреславле свою школу.
Пуркинье и его ученики (особенно следует выделить Г. Валентина) выявили в первом и самом общем виде микроскопическое строение тканей и органов млекопитающих (в том числе и человека). Пуркинье и Валентин сравнивали отдельные клетки растений с частными микроскопическими тканевыми структурами животных, которые Пуркинье чаще всего называл «зёрнышками» (для некоторых животных структур в его школе применялся термин «клетка»).
В 1837 г. Пуркинье выступил в Праге с серией докладов. В них он сообщил о своих наблюдениях над строением желудочных желёз, нервной системы и т. д. В таблице, приложенной к его докладу, были даны ясные изображения некоторых клеток животных тканей. Тем не менее установить гомологию клеток растений и клеток животных Пуркинье не смог:
- во-первых, под зёрнышками он понимал то клетки, то клеточные ядра;
- во-вторых, термин «клетка» тогда понимался буквально как «пространство, ограниченное стенками».
Сопоставление клеток растений и «зёрнышек» животных Пуркинье вёл в плане аналогии, а не гомологии этих структур (понимая термины «аналогия» и «гомология» в современном смысле).
Школа Мюллера и работа Шванна
Второй школой, где изучали микроскопическое строение животных тканей, была лаборатория Иоганнеса Мюллера в Берлине. Мюллер изучал микроскопическое строение спинной струны (хорды); его ученик Генле опубликовал исследование о кишечном эпителии, в котором дал описание различных его видов и их клеточного строения.
Теодор Шванн сформулировал принципы клеточной теории
Здесь были выполнены классические исследования Теодора Шванна, заложившие основание клеточной теории. На работу Шванна оказала сильное влияние школа Пуркинье и Генле. Шванн нашёл правильный принцип сравнения клеток растений и элементарных микроскопических структур животных. Шванн смог установить гомологию и доказать соответствие в строении и росте элементарных микроскопических структур растений и животных.
На значение ядра в клетке Шванна натолкнули исследования Матиаса Шлейдена, у которого в 1838 году вышла работа «Материалы по фитогенезу». Поэтому Шлейдена часто называют соавтором клеточной теории. Основная идея клеточной теории — соответствие клеток растений и элементарных структур животных — была чужда Шлейдену. Он сформулировал теорию новообразования клеток из бесструктурного вещества, согласно которой сначала из мельчайшей зернистости конденсируется ядрышко, вокруг него образуется ядро, являющееся образователем клетки (цитобластом). Однако эта теория опиралась на неверные факты.
В 1838 году Шванн публикует 3 предварительных сообщения, а в 1839 году появляется его классическое сочинение «Микроскопические исследования о соответствии в структуре и росте животных и растений», в самом заглавии которого выражена основная мысль клеточной теории:
- В первой части книги он рассматривает строение хорды и хряща, показывая, что их элементарные структуры — клетки развиваются одинаково. Далее он доказывает, что микроскопические структуры других тканей и органов животного организма — это тоже клетки, вполне сравнимые с клетками хряща и хорды.
- Во второй части книги сравниваются клетки растений и клетки животных и показывается их соответствие.
- В третьей части развиваются теоретические положения и формулируются принципы клеточной теории.
Именно исследования Шванна оформили клеточную теорию и доказали (на уровне знаний того времени) единство элементарной структуры животных и растений. Главной ошибкой Шванна было высказанное им вслед за Шлейденом мнение о возможности возникновения клеток из бесструктурного неклеточного вещества.
Развитие клеточной теории во второй половине XIX века
С 1840-х века учение о клетке оказывается в центре внимания всей биологии и бурно развивается, превратившись в самостоятельную отрасль науки — цитологию.
Для дальнейшего развития клеточной теории существенное значение имело её распространение на протистов (простейших), которые были признаны свободно живущими клетками (Сибольд, 1848).
В это время изменяется представление о составе клетки. Выясняется второстепенное значение клеточной оболочки, которая ранее признавалась самой существенной частью клетки, и выдвигается на первый план значение протоплазмы (цитоплазмы) и ядра клеток (Моль, Кон, Л. С. Ценковский, Лейдиг, Гексли), что нашло своё выражение в определении клетки, данном М. Шульце в 1861 г.: «Клетка — это комочек протоплазмы с содержащимся внутри ядром».
В 1861 году Брюкко выдвигает теорию о сложном строении клетки, которую он определяет как «элементарный организм», выясняет далее развитую Шлейденом и Шванном теорию клеткообразования из бесструктурного вещества (цитобластемы). Обнаружено, что способом образования новых клеток является клеточное деление, которое впервые было изучено Молем на нитчатых водорослях. В опровержении теории цитобластемы на ботаническом материале большую роль сыграли исследования Негели и Н. И. Желе.
Деление тканевых клеток у животных было открыто в 1841 г. Ремаком. Выяснилось, что дробление бластомеров есть серия последовательных делений (Биштюф, Н. А. Келликер). Идея о всеобщем распространении клеточного деления как способа образования новых клеток закрепляется Р. Вирховом в виде афоризма:
- «Omnis cellulae ex cellula».
- Всякая клетка — из другой клетки.
Уже у Шванна встречается попытка рассматривать организм как сумму клеток. Эта тенденция получает особое развитие в «Целлюлярной патологии» Вирхова (1858).
Работы Вирхова оказали неоднозначное влияние на развитие клеточного учения:
- Клеточная теория распространялась им на область патологии, что способствовало признанию универсальности клеточного учения. Труды Вирхова закрепили отказ от теории цитобластемы Шлейдена и Шванна, привлекли внимание к протоплазме и ядру, признанными наиболее существенными частями клетки.
- Вирхов направил развитие клеточной теории по пути чисто механистической трактовки организма.
- Вирхов возводил клетки в степень самостоятельного существа, вследствие чего организм рассматривался не как целое, а просто как сумма клеток.
- Будучи врачом, Вирхов обратил внимание на то, что нарушение функций организма есть следствие нарушений функций клеток, предвосхитив современную медицину. Поэтому его книга «Целлюлярная патология» имела огромный успех и во многом определила дальнейшее развитие медицинской науки.
Во второй половине XIX века были открыты и изучены основные механизмы деления клеток эукариот — митоз и мейоз, описаны хромосомы.
XX век
Взгляды Вирхова были развиты в «Целлюлярной физиологии» Ферворна, рассматривавшего любой физиологический процесс, протекающий в организме, как простую сумму физиологических проявлений отдельных клеток. В завершении этой линии развития клеточной теории появилась механистическая теория «клеточного государства», в качестве сторонника которой выступал в том числе и Геккель. Согласно данной теории организм сравнивается с государством, а его клетки — с гражданами. Подобная теория противоречила принципу целостности организма.
Механистическое направление в развитии клеточной теории подверглось острой критике. В 1860 году с критикой представления Вирхова о клетке выступил И. М. Сеченов. Позднее клеточная теория подверглась критическим оценкам со стороны других авторов. Наиболее серьёзные и принципиальные возражения были сделаны Гертвигом, А. Г. Гурвичем (1904), М. Гейденгайном (1907), Добеллом (1911). С обширной критикой клеточного учения выступил чешский гистолог Студничка (1929, 1934).
В 1950-е советский биолог О. Б. Лепешинская, основываясь на данных своих исследований, выдвинула «новую клеточную теорию» в противовес «вирховианству». В её основу было положено представление, что в онтогенезе клетки могут развиваться из некоего неклеточного живого вещества. Критическая проверка фактов, положенных О. Б. Лепешинской и её приверженцами в основу выдвигаемой ею теории, не подтвердила данных о развитии клеточных ядер из безъядерного «живого вещества».
В XX веке были изучены основные процессы клеточного метаболизма, а также установлена природа наследственной передачи признаков при размножении клеток — структура и механизм удвоения ДНК.
XX век внёс в клеточную теорию ряд корректив. Во-первых, была окончательно доказана неклеточная природа вирусов — особых форм жизни. Во-вторых, получила развитие теория симбиогенеза, внесшая корективы в представления о гомологии клеток (см.ниже). Однако в целом клеточная теория была подтверждена всем ходом развития биологии, а ее основные положения (в особенности положение о сходстве химического состава и процессов жизнедеятельности всех клеток) были более полно доказаны.
Клеточная теория включает три основных положения
[править]Современная клеточная теория включает следующие основные положения:
Клетка — элементарная единица живого
- 1. Клетка — элементарная единица живого, основная единица строения, функционирования, размножения и развития всех живых организмов.
Все клетки сходны по строению и химическому составу
- 2. Клетки всех одноклеточных и многоклеточных организмов имеют общее происхождение и сходны по своему строению и химическому составу, основным проявлениям жизнедеятельности и обмену веществ.
Клетки размножаются только делением
- 3. Размножение клеток происходит путём их деления. Новые клетки всегда возникают из предшествующих клеток.
Суть и значение основных положений клеточной теории
[править]
Клетка — простейшая биологическая система, обладающая полным набором свойств живого
[править]Клетка — элементарная единица живого. Как мы уже обсуждали, части клетки (макромолекулы. органеллы) не являются живыми, так как не обладают всем набором свойств живого. В большинстве своём они не могут размножаться. Могут размножаться митохондрии и хлоропласты — но это как раз связано с тем, что они — бывшие клетки бактерий (см. Теория симбиогенеза: происхождение митохондрий и хлоропластов). Кроме того, могут размножаться молекулы ДНК; но они (как и вирусы) способны делать это только внутри клеток, в присутствии произведенных на клеточных рибосомах ферментов. К тому же ни молекулы ДНК, ни вирусы не обладают другими свойствами живого (например, у них нет собственного обмена веществ). Поэтому только там, где есть клетки, могут присутствовать и реализовывать свои свойства другие уровни организации живого — особи, популяции и экосистемы.
Все клетки имеют общее происхождение и общие черты строения: замкнутую наружную мембрану, рибосомы и наследственный материал в виде молекул ДНК
[править]Клетки всех одноклеточных и многоклеточных организмов имеют общее происхождение и сходны по своему строению и химическому составу, основным проявлениям жизнедеятельности и обмену веществ. Иногда говорят, что все клетки гомологичны друг другу. В XX веке выяснилось, что клетки прокариот и эукариот — системы разного уровня организации (см.ниже). Гомология всех клеток свелась к наличию у них замкнутой наружной мембраны из двойного слоя фосфолипидов (да и то у архебактерий она имеет иной химический состав, чем у остальных групп организмов), хромосом — наследственного материала в виде молекул ДНК, образующих комплекс с белками — и рибосом. Это, конечно, не отменяет общего происхождения всех клеток, которое подтверждается общностью их химического состава.
Все клетки строят свои белки и ДНК из универсального набора мономеров — аминокислот и нуклеотидов
[править]В чем же состоит сходство химического состава всех клеток? Часто на этот счет пишут, что во всех клетках есть белки, жиры, углеводы и нуклеиновые кислоты. Но ведь они-то (особенно белки, РНК и ДНК) как раз во всех клетках разные!
На самом деле сходство химического состава состоит в том, что все белки всех живых организмов построены из одних и тех же мономеров — двадцати аминокислот (хотя мыслимых аминокислот существуют многие сотни), а ДНК всех организмов состоит из одних и тех же четырех нуклеотидов.
Кроме того, процессы функционирования (и некоторые белки, которые за них отвечают) в разных клетках настолько похожи, что с генов человека, встроенных в клетку бактерии, нормально считывается записанная в них генетическая информация и синтезируются человеческие белки!
Клетки не могут возникать путём самосборки
[править]Клетки размножаются только путем деления. Размножаться иначе клетки не могут потому, что в основе размножения клеток лежит удвоение ДНК. А условия для этого процесса ныне существуют только внутри клеток (правда, искусственно их можно создать и в пробирке). Отсюда следует непрерывность жизни с момента возникновения клетки; если жизнь возникла один раз (а это, скорее всего, так [4]), то все живые организмы на Земле имеют общих предков [5] — отсюда удивительное сходство строения и химического состава клеток. Из невозможности самосборки клеток в современных условиях следует невозможность самозарождения. Появляться же из предшествующих клеток новые клетки могут либо путем деления, либо путем слияния (так образуются, например, зиготы или клетки поперечнополосатых мышц из миобластов).
=
Дополнительные положения клеточной теории
[править]Для приведения клеточной теории в более полное соответствие с данными современной клеточной биологии список её положений часто дополняют и расширяют. Во многих источниках эти дополнительные положения различаются, их набор достаточно произволен.
- Клетки прокариот и эукариот являются системами разного уровня сложности и не полностью гомологичны друг другу (см.ниже).
- В основе деления клетки и размножения организмов лежит копирование наследственной информации — молекул нуклеиновых кислот («каждая молекула из молекулы»). Положения о генетической непрерывности относится не только к клетке в целом, но и к некоторым из её более мелких компонентов — к митохондриям, хлоропластам, генам и хромосомам.
- Многоклеточный организм представляет собой новую систему, сложный ансамбль из множества клеток, объединённых и интегрированных в системе тканей и органов, связанных друг с другом с помощью сложной системы межклеточной сигнализации.
- Клетки многоклеточных тотипотенты, то есть обладают генетическими потенциями всех клеток данного организма, равнозначны по генетической информации, но отличаются друг от друга разной экспрессией (работой) различных генов, что приводит к их морфологическому и функциональному разнообразию — к дифференцировке. (Из этого положения существует достаточно много исключений.)
Современное состояние клеточной теории
[править]Некоторые положения клеточной теории подверглись уточнению, детализации или изменению.
- Клеточная структура является главной, но не единственной формой существования жизни. Неклеточными формами жизни можно считать вирусы. Правда, признаки живого (обмен веществ, способность к размножению и т. п.) они проявляют только внутри клеток, вне клеток вирус является сложным химическим веществом. По мнению большинства учёных, в своём происхождении по крайней мере некоторые вирусы связаны с клеткой - являются частью её генетического материала, «одичавшими» генами.
- Выяснилось, что существует два типа клеток — прокариотические (клетки бактерий и архебактерий), не имеющие отграниченного мембранами ядра, и эукариотические (клетки растений, животных, грибов и протистов), имеющие ядро, окружённое двойной мембраной с ядерными порами. Между клетками прокариот и эукариот существует и множество иных различий. У большинства прокариот нет внутренних мембранных органоидов, а у большинства эукариот есть митохондрии и хлоропласты. В соответствии с теорией симбиогенеза, эти полуавтономные органоиды — потомки бактериальных клеток. Таким образом, эукариотическая клетка — система более высокого уровня организации, она не может считаться целиком гомологичной клетке бактерии (клетка бактерии гомологична одной митохондрии клетки человека).
- Считая клетку всеобщим структурным элементом, клеточная теория рассматривала как вполне гомологичные структуры тканевые клетки и гаметы, протистов и бластомеры. Применимость понятия клетки к протистам является дискуссионным вопросом клеточного учения в том смысле, что многие сложно устроенные многоядерные клетки протистов могут рассматриваться как надклеточные структуры. Гаметы животных или растений — это не просто клетки многоклеточного организма, а особое гаплоидное поколение их жизненного цикла, обладающее генетическими, морфологическими, а иногда и экологическими особенностями и подверженное независимому действию естественного отбора. В то же время практически все эукариотические клетки, несомненно, имеют общее происхождение и набор гомологичных структур — элементы цитоскелета, рибосомы эукариотического типа и др.
- В многоклеточных организмах кроме клеток есть многоядерные надклеточные структуры (синцитии, симпласты) и межклеточное вещество, обладающее способностью к метаболизму и потому живое. В то же время и многоядерные структуры, и межклеточное вещество появляются только из клеток. Синцитии и симпласты многоклеточных — продукт слияния исходных клеток, а межклеточное вещество — продукт их секреции, то есть образуется оно в результате метаболизма клеток.
- Клетки многоклеточного организма не являются индивидуумами, способными существовать самостоятельно (так называемые культуры клеток вне организма представляют собой искусственно создаваемые биологические системы). К самостоятельному существованию способны, как правило, лишь те клетки многоклеточных, которые дают начало новым особям (гаметы, зиготы или споры) и могут рассматриваться как отдельные организмы. Клетка не может быть оторвана от окружающей среды (как, впрочем, и любые живые системы). Для понимания работы организма недостаточно изучить отдельные клетки — необходимо разобраться в их взаимодействиях.
Дополненная новыми данными клеточная теория остается одним из важнейших биологических обобщений.
Происхождение жизни и происхождение клеток
[править]Last Universal Common Ancestor (LUCA; последний универсальный общий предок, англ.)
Происхождение клеток
[править]Существуют разные теории происхождения клеток
Согласно одной группе теорий, жизнь (в виде клеток или доклеточных форм) попала на Землю из космоса в составе комет или метеоритов (гипотеза панспермии). Согласно другим, в настоящее время преобладающим теориям, жизнь появилась на Земле из неживой материи путем абиогенеза. Все теории абиогенеза предполагают, что существовали доклеточные формы жизни в виде систем, в которых молекулы приобрели способность к самокопированию и обмену веществ. Как произошел переход от таких систем к первым клеткам, неизвестно. Предполагается, что все современные клеточные формы жизни имели общего предка - сообщество (или вид?) клеточных организмов с определенным признаками. Этот гипотетический организм получил название LUCA - last universal common ancestor, последний (ближайший) универсальный общий предок. От него произоши современные домены клеточных организмов - бактерии, археи и эукариоты. В эволюции жизни ему могли предшествовать многие другие клети, чьи потомки не дожили до наших дней.
Происхождение эукариот
[править]Эукариотические клетки — системы более высокого уровня организации, чем прокариотические
Клетки эукариот — сложные генетические системы, имеющие другой уровень организации, чем прокариотические клетки.
Во-первых, у эукариот намного сложнее устроена система регуляции работы генов. Это позволяет им приспосабливаться к более разнообразным условиям среды без изменений в их ДНК. Многоклеточным организмам это позволяет создавать разные типы клеток, имеющие один и тот же генотип.
Во-вторых, у подавляющего большинства эукариот есть митохондрии, а у многих ещё и пластиды. Согласно общепризнанной в настоящее время точке зрения, эти органоиды имеют симбиотическое происхождения. Их предками были бактерии, которые вступили в симбиоз с предками эукариот.
Теория симбиотического (симбиогенного) происхождения органоидов клетки получила название теории симбиогенеза.
Подборка статей по проблеме происхождения эукариот
Теория симбиогенеза
[править]Теорию симбиогенеза создали русские учёные, а ввела в современный научный обиход американский исследователь Линн Маргелис
[править]Теория эндосимбиотического происхождения хлоропластов впервые была предложена в 1883 году Андреасом Шимпером, показавшим их саморепликацию внутри клетки. Её возникновению предшествовал вывод А. С. Фаминцина и О. В. Баранецкого о двойственой природе лишайников — симбиотического комплекса гриба и водоросли (1867 год). К. С. Мережковский в 1905 году предложил само название «симбиогенез», впервые детально сформулировал теорию и даже создал на её основе новую систему органического мира.
Он предложил деление органическлого мира на «микоплазму» и «амебоплазму», во многом предугадав деление, соответственно, на прокариот и эукариот (правда, к прокариотам он ошибочно отнёс грибы). Мережковский также предполагал симбиогеное присхождение ядра от клетки прокариота, внедрившегося в другую клетку — эту идею и сейчас поддерживают некоторые учёные.
Фаминцин в 1907 году, опираясь на работы Шимпера, также пришёл к выводу, что хлоропласты являются симбионтами, как и в случае с водорослями лишайника.
В 1920-е годы теорию симбиогенеза развивал российский ботаник Б. М. Козо-Полянский [6]. Его работы, публиковавшиеся на русском языке, остались полностью неизвестными на западе. Ещё более чётко, чем Мережковский, Козо-Полянский осознал и обозначил границу между про- и эукариотами. Теорию симбиогенеза он распространил на митохондрии (и другие органоиды, включая ядро). Он также отчасти предвосхитил современные представления о внеядерной наследственности. Хотя у симбиогенеза находились адепты и в 30-40-е годы, в целом эту теорию большинство учёных считали ненаучной фантастикой. Второе рождение расширенная и конкретизированная теория получила в работах Линн Маргулис (Маргелис) начиная с 1960-х гг. Маргелис высказала предположение о симбиотическом происхождении не только митохондрий и хлоропластов, но и жгутиков (от спирохет), которое в дальнейшем не получило подтверждения.
Согласно теории симбиогенеза, митохондрии и хлоропласты — потомки бактерий, вступившие в симбиоз с предками эукариот
[править]Современная теория симбиогенеза утверждает, что митохондрии и хлоропласты — потомки определённых групп бактерий, которые вступили в симбиоз с предками современных эукариот. В ходе эволюции бактерии-эндосимбионты превратились в полуавтономные органоиды. Они сохранили способность синтезировать некоторые белки автономно от клетки-хозяина и способность размножаться путем деления. Но значительная часть генетического материала митохондрий и хлоропластов переместилась в ядро. В результате эти органоиды утратили способность размножаться вне клетки-хозяина, свойственную многим симбиотическим бактериям.
Митохондрии и хлоропласты имеют признаки минимальной клетки — замкнутую наружную мембрану, ДНК, белоксинтезирующий аппарат и размножение делением
[править]- имеют две полностью замкнутые мембраны. При этом их внутренняя мембрана кое в чем сходна по липидному составу с цитоплазматической мембраной бактерий
- размножаются делением пополам, причем делятся иногда независимо от деления клетки, никогда не синтезируются заново
- генетический материал — кольцевая ДНК, не связанная с гистонами (По доле ГЦ-пар ДНК митохондрий и пластид ближе к ДНК бактерий, чем к ядерной ДНК эукариот)
- имеют свой аппарат синтеза белка — рибосомы и др.
- рибосомы прокариотического типа — c константой седиментации 70S. По строению 16s рРНК близки к бактериальной
- многие белки этих органелл похожи по своей первичной структуре на аналогичные белки бактерий и не похожи на соответствующие белки цитоплазмы
Анализ нуклеотидных последовательностей ДНК митохондрий и хлоропластов свидетельствует о том, что каждый из этих органоидов был приобретены предками эукариот однократно. Все митохондрии всех современных эукариот имеют одного общего предка, сходного с современными альфа-протеобактериями. Все хлоропласты тоже имеют одного общего предка, сходного с современными цианобактериями. Особенно близки к предкам хлоропластов по строению мембран и составу фотосинтетических пигментов бактерии рода прохлорон (Prochloron).
Отдельного комментария заслуживает наличие двух мембран у митохондрии и «типичных» хлоропластов. Широко распространенное заблуждение – бактериальное происхождение одной внутренней мембраны и возникновение внешней мембраны из мембраны пищеварительной вакуоли. Оно настолько укоренилось, что тиражируется во вполне солидных и уважаемых источниках (см., например, h учебник Альбертса «Молекулярная биология клетки», 5-е издание).
На самом же деле наружная мембрана митохондрий и хлоропластов гомологична наружной мембране их предков – грамотрицательных бактерий. «Бегство» из пищеварительной вакуоли – обычная тактика многих внутриклеточных бактерий. Так ведут себя многие возбудители болезней человека – листерии, риккетсии и др.
Во-первых, если бы наружная мембрана была гомологична мембране фагосомы, то белки в нее доставлялись путем везикулярного транспорта. Если это и происходит, то в виде исключения; в целом митохондрии и пластиды изолированы от «единой» мембранной системы, белки и липиды доставляются в них с помощью особых механизмов. Во-вторых, только в наружной мембране митохондрий, хлоропластов и грамм-отрицательных бактерий встречается уникальное семейство белков из группы бета-бочек, и только в этих мембранах работает уникальный, имеющий общее происхождение механизм встраивания этих белков.
Геном митохондрий
Наиболее полный из изученных геномов митохондрий у протиста Reclinomonas. В ДНК его митохондрии содержится более 60 «белковых» генов. У этого протиста в митохондриальной ДНК закодированы 27 рибосомальных белков, а также 23 белка, участвующих в работе электронтранспортной цепи и в окислительном фосфорилировании. Кроме того, у этого же протиста в мтДНК закодированы как минимум пять белков, участвующих в транскрипции (субъединицы РНК-полимеразы) и трансляции.
У человека (как и у большинства животных) в ДНК митохондрий кодируются рРНК митохондриальных рибосом и большинство типов митохондриальных тРНК. При этом геном митохондрий человека и других млекопитающих содержит всего 13 «белковых» генов из примерно 1500 генов, кодирующих белки митохондриального протеома.
Геном пластид
Перенос генов из органоидов в ядро
Таким образом, очевидно, что большинство генов предков митохондрий и хлоропластов переместились из митохондрий в ядро и встроились в ядерный материал клетки-хозяина. Механизмы этого процесса не вполне ясны; предполагается участие в них мобильных генетических элементов или вирусов. Но сама возможность «горизонтального переноса генов» между бактериями и ядром эукариотической клетки не подлежит никакому сомнению. Сейчас известно множество генов растений, протистов и животных, явно полученных путем горизонтального переноса от прокариот. Наблюдается такой перенос и от внутриклеточных эндосимбионтов или паразитов. Так, бактерия Agrobacterium tumefaciens встраивает свои гены в хромосомы растений с помощью специальных плазмид, а бактерия Wolbachia встроила в хромосому некоторых насекомых-хозяев свой практически полный геном.
Геном митохондрий имеет необычные черты, в том числе отклонения от универсального генетического кода
[править]Необычные черты генома митохондрий
В иРНК митохондрий особенно часто встречаются вариации стандартного генетического кода, которые приведены в таблице.
| Пример | Кодон | Обычное значение | Читается как: |
|---|---|---|---|
| Митохондрии, в частности у Saccharomyces cerevisiae | CU(U, C, A, G) | Лейцин | Серин |
| Митохондрии высших растений | CGG | Аргинин | Триптофан |
| Митохондрии (у всех без исключения исследованных организмов) | UGA | Стоп | Триптофан |
| Митохондирии млекопитающих, дрозофилы, S. cerevisiae и многих простейших | AUA | Изолейцин | Метионин = Старт |
| Митохондрии млекопитающих | AGC, AGU | Серин | Стоп |
| Митохондрии дрозофилы | AGA | Аргинин | Стоп |
| Митохондрии млекопитающих | AG(A, G) | Аргинин | Стоп |
У большинства изученных организмов митохондрии содержат только кольцевые молекулы ДНК, у некоторых растений одновременно присутствуют и кольцевые, и линейные молекулы, а у ряда протистов (например, инфузорий) имеются только линейные молекулы.
Митохондрии млекопитающих обычно содержат от двух до десяти идентичных копий кольцевых молекул ДНК.
У растений каждая митохондрия содержит несколько молекул ДНК разного размера, которые способны к рекомбинации.
Митохондрии кинетопластид имеют необычное строение и генетический аппарат
[править]У протистов из отряда кинетопластид (например, у трипаносом) в особом участке митохондрии (кинетопласте) содержится два типа молекул ДНК — идентичные макси-кольца (20-50 штук) длиной около 21 т.п.о. и мини-кольца (20 000 — 55 000 штук, около 300 разновидностей, средняя длина около 1000 п.о.). Все кольца соединены в единую сеть (катенаны), которая разрушается и восстанавливается при каждом цикле репликации. Макси-кольца гомологичны митохондриальной ДНК других организмов. Каждое мини-кольцо содержит четыре сходных консервативных участка и четыре уникальных гипервариабельных участка.
В мини-кольцах закодированы короткие молекулы направляющих РНК (guideRNA), которые осуществляют редактирование РНК, транскрибируемых с генов макси-колец.
- [7] Дымшиц Г. М. Сюрпризы митохондриального генома. Природа, 2002, N 6
- [8] Статья об особенностях кинетопластного генома трипаносом (англ.)
- [9] Origin and evolution of mitochondrial proteome
Пластиды многих водорослей отличаются от пластид высших растений строением и составом пигментов
[править]В большинстве учебников ботаники и физиологии растений описаны пластиды (хлоропласты), характерные для цветковых растений. Они имеют две наружные мембраны, тилакоиды, собранные в стопки — граны, и два основных фотосинтетических пигмента — хлорофилл а и хлорофилл b.Но на самом деле пластиды гораздо разнообразнее и по строению, и по составу пигментов.
Первичные пластиды характерны, кроме высших растений, для зелёных и харовых водорослей, красных водорослей и глаукофитовых. Все эти пластиды окружены двумя мембранами. Считается. что они были приобретены в результате симбиоза гетеротрофных жгутиковых эукариот с предками хлоропластов — цианобактериями.
При этом и у этих групп водорослей пластиды заметно различаются. У зелёных и харовых водорослей пластиды по строению и составу пигментов такие же, как у высших растений. Считается, что высшие растения произошли от водорослей, сходных с харовыми. По строению их хлоропласты наиболее сходны с цианобактерией Prochloron. Эти пластиды содержат две формы хлорофилла — хлорофилл а и хлорофилл b. Те же формы хлорофилла имеет и Prochloron.
У красных и глаукофитовых водорослей тилакоиды не собраны в граны, а на их поверхности сидят особые тельца — фикобилисомы. Они состоят из белков фикобилипротеинов. Окраску им придают входящие в их состав хромофоры фикобилины: фикоэритрин — красную, а фикоцианин — голубоватую. Они улавливают свет и передают его хлорофиллу а. У красных водорослей и некоторых цианобактерий есть также хлорофилл d.
По строению и составу пигментов эти хлоропласты наиболее сходны с большинством видов цианобактерий. При этом хлоропласты глаукофитовых водорослей имеют удивительную особенность: между двумя мембранами у них есть слой пептидогликана — вещества, образующего клеточные стенки бактерий. Эти хлоропласты, называемые часто цианеллы, рассматривают как «живые ископаемые» — эндосимбиотические органеллы, сохранившие примитивные предковые признаки.
Вторичные пластиды характерны для большинства групп водорослей. Они были приобретены в результате эндосимбиоза гетеротрофных протистов с автотрофными протистами, то есть в результате поглощения хищником-эукариотом другого эукариота — автотрофа, уже имевшего первичные пластиды. Исходно вторичные пластиды окружены четырьмя мембранами (снаружи внутрь - мембрана пищеварительной вакуоли, плазмалемма эукариотической клетки, две мембраны первичной пластиды). Впоследствии у многих групп водорослей одна или две их четырех мембран вторичных пластид редуцировались, а у некоторых все четыре мембраны сохранились.
Наиболее близки к исходному строению хлоропласты криптофитовых водорослей и хлорарахиевых водорослей. У этих небольших групп одноклеточных водорослей хлоропласты окружены четырьмя мембранами. У криптофитовых они содержат хлорофилл а, хлорофилл с и фикобилипротеины. У хлорарахниевых присутствуют хлорофилл а и хлорофилл b. Между второй и третьей мембраной находится нуклеоморф — рудиментарное ядро с сильно уменьшенным ядерным геномом.
Сейчас секвенированы полные геномы всех компартментов обоих групп водорослей. Оба исследованных нуклеоморфа содержат по три маленькие хромосомы (у изученной криптофитовой водоросли общий размер генома всего 550.000 п.н.). Из белковых генов нуклеоморфов всего примерно по 30 генов кодируют белки для первичной пластиды; остальные — это в основном «гены домашнего хозяйства» Их тоже не хватает: в перипластидное пространство (т.е. в эукариота-симбионта) попадает из цитоплазмы хозяина более 2000 белков у криптофитовых и около 1000 у хлорарахниевых. В свою очередь, из нуклеоморфов в ядро переместились сотни генов. Геном нуклеоморфа у криптофитовых очень компактный: в нем короткие интроны, почти нет спейсеров, а 91 % последовательностей – кодирующие, как у прокариот!
У гаптофитовых и диатомовых водрослей, недавно открытого фототрофного протиста Chromera velia и у ее ближайших родствеников споровиков (Apycomplexa) есть четырехмембранные пластиды, утратившие нуклеоморф. У других водорослей (например, динофлагеллят и эвгленовых) встречаются трехмембранные хлоропласты со своеобразным набором хлорофиллов. Наличие трёх мембран можно объяснить тем, что после двойного симбиоза (как у криптофитовых) одна из мембран редуцировалась.
По-видимому, в данном случае это была наружная мембрана клетки эукариотического симбионта; сохранились обе мембраны первичной пластиды и мембрана фагосомы.
Кем же были предки вторичных пластид? Сейчас считается, что хлорарахниевые и эвгленовые независимо друг от друга поработили зелёные водоросли. Все остальные группы, имеющие вторичные пластиды, приобрели в свое время в качестве симбионта красную водоросль.
[10]Patrick J. Keeling. Diversity and evolutionary history of plastids and their hosts.
Царства живой природы
[править]Две крупнейшие группы клеточных организмов — прокариоты и эукариоты
[править]Две основные группы клеточных организмов — прокариоты и эукариоты. При этом уже достаочно давно укоренилось деление живых организмов на три группы самого высокого ранга — археи (архебактерии), бактерии (эубактерии) и эукариоты. Археи, несомненно, являются типичными прокариотами, и прокариот можно разделить на два царства — бактерии и археи. За последние десятилетия было доказано, что археи отделились от общего эволюционного древа позднее бактерий [[11]], и в соответствии с принципами кладистики их следовало бы объединить в один таксон с эукариотами. По последним данным, существует группа архей (асгардархеи),более бликородственная эукариотам,чем остальным археям. Таким образом, прокароты - это не таксон (не клада), а уровень организации (града). Впротивопложность этому, у всех эукариот (точнее, у их цитоплазматического компартмента)был один общий предок, иони представляют собой таксон.
К прокариотам относятся царства бактерий и архей
[править]Деление эукариот на царства не устоялось
[править]Гораздо сложнее обстоит дело с царствами в пределах надцарства эукариот (см. Система органического мира). Ещё недавно эукариот делили на три царства — растения, животные и грибы (это деление сохранилось в школьных учебниках, а отчасти и в вузовских — см., например, И. Х. Шарова. Зоология беспозвоночных. М., Владос, 2002).
При этом всех одноклеточных и колониальных эукариот пытались «распихать» по этим трём царствам — инфузорий и амёб относили к животным, хлореллу и хламидомонаду (и всех остальных водорослей) — к растениям, а миксомицетов — к грибам. Затем всё чаще стали выделять четвертое царство — протисты. Выделить его пришлось из-за того, что стало ясно — многие одноклеточные эукариоты вовсе не родственны ни растениям, ни животным, ни грибам.
Но одновременно благодаря исследованию ультраструктуры клеток выяснилось, что и друг другу разные протисты — очень дальние родственники. В то же время среди них есть формы, явно близкородственные и высшим растениям (это зеленые водоросли и харовые водоросли), и животным (это воротничковые жгутиконосцы), и грибам (а сами грибы, как оказалось — довольно близкие родственники животных).
В дальнейшем эти данные были подтверждены и при сравнении последовательностей ДНК, методы анализа которых всё время усовершенствуются (см. биоинформатика).
Что же с этим делать? Если следовать принципам кладистики, необходимо «пожертвовать» привычными нам царствами растений, животных и грибов (и уж тем более протистов) и выделить новые царства, основанные на истинном родстве составляющих их групп организмов.
Этим и заняты сейчас специалисты (см. Система органического мира, [12]). Некоторые из них идут по компромиссному пути: сохраняя царства животных и растений (выделенные на основе их сложного тканевого строения и особенностей размножения и жизненного цикла), в остальном используют кладистический подход (см., напр., [13]).
Учитывая цели данного учебника, мы будем придерживаться традиционного деления эукариот на четыре царства (растения, животные, грибы и протисты) и будем сравнивать клетки животных, растений и грибов между собой. Помните, что среди протистов встречаются все три варианта строения (то есть клетки, сходные с клетками животных, растений и грибов), а также множество иных вариантов, не похожих на клетки представителей трёх «высших» царств.
Прокариоты и эукариоты различаются комплексом взаимосвязанных признаков
[править]| Признаки | Прокариоты | Эукариоты |
|---|---|---|
| Типичные размеры1 | Диаметр клетки 1-2 мкм | Диаметр клетки 10-20 мкм |
| Клеточная стенка | Обычно имеется, у большинства содержит пептидогликан | Часто отсутствует; при наличии не содержит пептидогликана |
| Наличие цитоскелета | Слабее развит, используется только для делении и поддержания формы клетки | Хорошо развит, часто используется при локомоции и внутриклеточном транспорте |
| Жгутики | Бактериальный жгутик — флагелла; внуклеточная трубка из белка, при движении вращается | Эукариотический жгутик — ундулиподия; вырост клетки, окруженный мембраной, при движении изгибается |
| Эндоцитоз и внутриклеточное пищеварение | У всех отсутствуют | У большинства имеются |
| Ядерная оболочка | Всегда отсутствует | Всегда имеется, состоит из двух мембран, содержит ядерные поры |
| ДНК основной части генома | Как правило, одна кольцевая молекула ДНК (генофор) | Как правило, несколько линейных молекул ДНК (хромосомы) |
| Строение рибосом | 70S-типа, содержат 3 молекулы рРНК | В цитоплазме 80S-типа, содержат 4 молекулы рРНК; в митохондриях и хлоропластах 70S-типа, содержат 2 или 3 молекулы рРНК |
| Эндомембранная система | Обычно слабо развита | Обычно хорошо развита, включает ЭПС, аппарат Гольджи, лизосомы и другие мембранные органоиды |
| Эндосимбиоз с другими клетками | Не встречается | Практически все клетки содержат эндосимбионтов — митохондрии, хлоропласты, симбиотические бактерии |
| Способы деления клетки | «Прямое» деление (в том числе почкование) без участия веретена деления | Митоз и мейоз с участием веретена деления из микротрубочек |
| Обмен веществ | Разнообразный, у многих есть азотфиксация и хемосинтез | Гликолиз в цитоплазме, оксигенный фотосинтез в хлоропластах, кислородное (реже нитратное) дыхание в митохондриях. |
1Пределы размеров широко перекрываются
Клетки прокариот имеют сравнительно простое строение
[править]

Как и у любой клетки, у клетки бактерий есть замкнутая наружная мембрана. У большинства бактерий поверх наружной мембраны имеется толстая клеточная стенка, а поверх неё иногда есть еще слизистая капсула. Внутренние мембраны для прокариот не характерны, хотя у части видов есть внутриклеточные мембранные органоиды — мезосомы, газовые вакуоли, мембраны, участвующие в фотосинтезе. Как и у всех клеток, у прокариот присутствуют рибосомы. Они отличаются от рибосом эукариот тем, что имеют меньшие размеры, содержат не 4, а 3 молекулы рРНК и меньшее число белков (см. Рибосомы — машины для синтеза белка).
В клетках прокариот отсутствует ядро, окруженное у эукариот двумя мембранами. Их ДНК содержится в особой области цитоплазмы — нуклеоиде. Там содержатся также РНК и белки, в том числе и связанные с ДНК. Однако у большинства прокариот нет нуклеосомной укладки ДНК.
Клеточная стенка защищает клетку от разрушения при осмотическом шоке. Обычно внутри клетки бактерии высоко осмотическое давление. Если клетку бактерии в её обычной среде лишить клеточной стенки, она лопнет. На этом основано действие антибиотиков пенициллинового ряда. Они блокируют работу фермента DD-транспептидазы, осуществляющего синтез муреина. Делящиеся клетки не могут достраивать клеточную стенку и лопаются.

У грамположительных бактерий поверх мембраны имеется клеточная стенка, содержащая особое вещество — муреин, или пептидогликан. Толщина пептидогликанового слоя у них составляет 20-80 нм. У грамотрицательных бактерий пептидогликановый слой гораздо тоньше (7-8 нм), а поверх него имеется еще одна — наружная — мембрана. Таким образом, у грамотрицательных бактерий клетка окружена двумя мембранами, между которыми есть периплазматическое пространство, содержащее тонкий пептидогликановый слой. К наружной мембране грамотрицательных бактерий крепятся липополисахариды, часто отвечающие за их патогенность.
Клетки бактерий обычно покрыты также S-слоем — слоем из одного белка, толщиной в одну молекулу, который у грамположительных бактерий крепится к пептидогликановой клеточной стенке, а у грамотрицательных — к наружной мембране, образуя комплекс с липополисахаридами.
- [14] — Микробиология (учебник для студентов фармацевтических институтов)
- [15] — Современная бактериология (англ.)
Хотя размеры клеток прокариот и эукариот широко варьируют и сильно (почти полностью) перекрываются, тем не менее, характерные размеры прокариотических и эукариотических клеток все же заметно различаются. Клетка типичной бактерии или археи имеет диаметр 1-2 мкм. Большинство клеток животных имеют диаметр около 10-20 мкм, клетки растений и грибов в среднем еще крупнее. обратите внимание, что десятикратные различия в диаметре означают тысячекратные различия в объеме и массе: внутри клетки человека могут поместиться не десять бактерий, а тысяча.
Разберем подробнее основные признаки клеток эукариот и их отличия от прокариот.
Основные органеллы эукариотической клетки имеют однотипное строение и функции у представителей разных царств
[править]
Клеточная мембрана (плазмалемма) состоит из двух слоёв молекул фосфолипидов. Фосфолипиды состоят из гидрофильной «головки» и из двух гидрофобных «хвостов». Кроме липидов, в состав мембраны входят белки, помогающие мембране выполнять самые разные функции. Толщина мембраны 6-7 нм. На внешней стороне мембраны у животных находится слой олигосахаридов – гликокаликс.
Основные свойства мембраны - полупроницаемость, текучесть, гибкость, способность к самозамыканию и неспособность сильно растягиваться.
Функции мембраны:
1. Отграничение от внешней среды.Мембрана не позволяет клетке «растекаться», а её жидкому внутреннему содержимому - смешиваться с окружающей водной средой.
2. Транспортная функция. Вещества могут проходить через мембрану двумя способами - активным и пассивным. В случае пассивного транспорта вещества проходят мембрану с помощью диффузии. При активном транспорте затрачивается энергия, и обеспечивают его специальные белки-насосы.
3. Восприятие сигналов из внешней среды. На поверхности мембраны находятся белки-рецепторы, принимающие сигналы из внешней среды.
4. Образование межклеточных контактов.
Подробнее строение, свойства и функции мембраны разобраны в разделе #Строение и функции плазматической мембраны
2.) Цитоскелет
Цитоскелет находится в цитоплазме клетки. Он состоит из актиновых микрофиламентов, промежуточных филаментов (есть не во всех клетках) и микротрубочек.
Актиновые филаменты. Диаметр актиновых филаментов 6-8 нм. Состоят из белка актина. Могут собираться и разбираться. ВЗаимодействуя с моторными белками миозинами, обеспечивают цитокинез (у животных), амебоидное движение, мышечное сокращение.
Промежуточные филаменты. Диаметр промежуточных филаментов 9-11 нм. Состоят из кератинов и других фибриллярных белков. Обеспечивают механическую прочность эпителиев, аксонов нервных клеток и других структур. Образуют внутреннюю выстилку ядерной мембраны (ламину), к которой крепятся хромосомы.
Микротрубочки Диаметр микротрубочек 23-25 нм. Микротрубочки состоят из белка тубулина. Они могут собираться и разбираться. Наряду с другими органеллами входят в состав цитоскелета. Создают веретено деления при митозе и мейозе.
Функции:
1. Поддержание и изменение формы клетки; цитокинез
2. Образование веретена деления, "растаскивание" хромосом при делении
3. Ресничное движение. Ресничное движение создается в результате работы ресничек. Реснички состоят из микротрубочек, которые соединены с центриолями.
4. Амебоидное движение
5. Мышечное сокращение
6. Внутриклеточный транспорт везикул и макромолекул
Подробнее строение и функции цитоскелета рассматриваются в разделе #Цитоскелет и клеточная подвижность.

Реснички и жгутики эукариот - подвижные выросты клетки, одетые наружной мембраной. Внутри них имеется сложная система микротрубочек, у подвижных ресничек и жгутиков их обычно 20 (9 пар по периферии и одна пара в центре). В основании ресничек и жгутиков лежит базальное тельце, сходное по строению с центриолью. Подвижные реснички обычно совершают удары в одной плоскости, жгутики - сложное вращательное движение.
Функции:
Ресничное и жгутиковое движение используют одноклеточные эукариоты (жгутиокносцы, инфузории, гаметы многих животных) и мелкие многоклеточные (плоские черви, личинки губок, книдарий и других беспозвоночных)
Подвижные реснички и жгутики могут обеспечивать ток жидкости у поверхности тела или во внутренних полостях (например, у человека - ток спинномозговой жидкости. ток слизи в воздухоносных путях, выносящий из них пыль и микробов)
Неподвижные видоизмененные реснички часто служат воспринимающим аппаратом клеток-рецепторов. Так, у человека видоизмененные реснички обеспечивают восприятие света и запахов.
7.) Центриоли
Помогают в формировании веретена деления, как и микротрубочки. Обычно расположены в паре, около ядра.
Функции:
1. Центр организации микротрубочек
8.) Микроворсинки
Микроворсинки находятся в кишечнике. Их основная функция - всасывание питательных веществ.
9.) Ядро
Окружено двумя мембранами со множеством ядерных пор. Ядерные поры обеспечивают транспорт веществ. Самая крупная из органелл клетки.
Функции:
1. Хранение генетической информации.
2.Управление делением.
3.Синтез ДНК и РНК
10.)Ядрышко
Ядрышко - это особая область ядра, содержит участки хромосом (ядрышковый организатор). Ядрышко состоит из белка и рибосомальной РНК и не окружено мембраной. В ядрышке самая высокая концентрация белка во всей клетке.
Функция:
1.Синтез рРНК и сборка субъединиц рибосом
11.)Рибосомы
Мелкие немембранные клеточные органеллы. Клетка содержит около десятка тысяч рибосом. Они состоят из белков и рибонуклеиновых кислот.
Функция:
1.Синтез белков
12.) Лизосомы
Лизосомы окружены одной мембраной. Они содержат до 40 различных ферментов, которые могут переваривать разные вещества, поступающие в клетку путем эндоцитоза. Производятся в аппарате Гольджи.
Функции:
1.Внутриклеточное пищеварение. Содержат большое количество пищеварительных ферментов, способных расщеплять все группы органических веществ.
2.Аутофагия. При остром голодании лизосомы способны переваривать органеллы клетки. Лизосомы «съедают» органеллы клетки и в случае их повреждения.
4.Переваривание межклеточного вещества.
13.) Митохондрии

Окружены двумя мембранами. Их количество в некоторых клетках может достигать нескольких сотен. Существует теория, согласно которой митохондрии (и хлоропласты) – бывшие бактерии, вступившие в симбиоз с клеткой.
Функции:
1. Синтез АТФ
2. Клеточное дыхание
14.) Аппарат Гольджи
Аппарат Гольджи — одномембранный органиод. Он состоит из мембранных структур - цистерн. Функции:
1. Сортировка белков, синтезированных в сидячих рибосомах.
2.Образование лизосом
3.Секреция
15.) Эндоплазматическая сеть (ЭПС) ЭПС — одномембранный органоид.
Функции:
1.Синтез белков, липидов и углеводов
2.Обезвреживание ядовитых веществ, попавших в организм
3.Транспортная функция
Клетки эукариот крупнее клеток прокариот на три порядка
[править]Типичные клетки эукариот имеют линейные размеры не 1-5, а 10-50 мкм. Это означает, что по объему такая клетка в 1 000 раз больше, чем типичная бактериальная.
В последние десятилетия найдено несколько десятков видов очень мелких эукариот, входящих в состав морского планктона. В основном это представители празинофитовых водорослей и некоторых других групп водорослей. Празинофитовая водросль Ostreococcus — самый мелкий из известных свободноживущих эукариот — имеет средний диаметр клеток 0,8 мкм.
Следствия этого очень важные. При увеличении размеров объём растет пропорционально кубу линейных размеров, а площадь поверхности тела — пропорционально квадрату. Если, например, взять куб с ребром 1 см, а затем увеличить ребро вдвое, то объём куба возрастет в 8 раз (у первого куба объём 1 см³, а у второго — 8 см³. Площадь поверхности первого куба равна 1х1х6 = 6 см², а второго куба — 2х2х6=24 см²; таким образом, площадь поверхности выросла только в 4 раза. Относительная площадь поверхности (отношение площади поверхности к объему) у первого куба — 6/1 (см²/ см³), а у второго — только 24/8 = 3/1 (см²/ см³).
- Вопрос
- Какова относительная площадь поверхности у куба с ребром n см?
Так как бактерии поглощают питательные вещества всей поверхностью клетки, маленькие размеры обеспечивают им быстрые темпы роста и размножения. Этим обусловлена их важная роль в круговоротах веществ.
Скорость перемещения молекул при диффузии пропорциональна корню квадратному из расстояния. Это означает, что молекула, пройдя расстояние в 1 мкм за 1 секунду, пройдет расстояние в 2 мкм за 10 с, а расстояние в 10 мкм — за 100 с. Однако реально малые молекулы диффундируют в цитоплазме достаточно быстро — расстояние в 10 мкм они проходят в среднем за 0,1 с. Однако и эта сравнительно высокая скорость может лимитировать скорость обмена веществ. Как же можно повысить эту скорость?
Для клеток эукариот характерна компартментализация
[править]Чтобы химические реакции шли быстрее, нужно увеличить концентрацию реагирующих веществ. Это можно сделать, если сконцентрировать определенные вещества — ферменты и их субстраты — внутри замкнутого пространства. В разных таких «отсеках» можно создать условия (например, рН), оптимальные для протекания конкретных реакций.
Видимо, в связи с этим в клетках эукариот и возникли компартменты #— «отсеки», отделенные мембранами от цитоплазмы и друг от друга. Говорят, что для клеток эукариот характерна компартментализация (компартментация).
Есть и другие способы повышения скорости химических реакций в клетке. Расчеты показывают, что для столкновения двух молекул (например, конкретных молекул фермента и субстрата) внутри сферы диаметром 10 мкм потребуется в среднем около 30 минут. Если же фермент закреплен на мембране, перегораживающей сферу пополам, а субстрат сначала при диффузии натыкается на мембрану, а затем диффундирует в её плоскости (внутри неё), то время до соударения уменьшается до 2 минут. Если же уменьшить площадь мембраны, то время становится ещё меньше — около 20 секунд. Видимо, этот факт играет важную роль в синтезе липидов, за который отвечают ферменты, закрепленные на мембранах эндоплазматической сети. Эти же закономерности могут играть важную роль в ускорении передачи сигналов, например, от мембранных рецепторов, в которой участвуют связанные с мембраной G-белки.
Клетки животных, растений и грибов различаются деталями строения
[править]Клетки животных, высших растений (а тем более водорослей) и грибов достаточно разнообразны. Когда в учебниках перечисляют их различия, обычно имеют в виду цветковые растения, позвоночных животных и каких-нибудь высших грибов (например, базидиомицетов). Так же поступим и мы.
- Растительные и грибные клетки обладают плотной клеточной стенкой (целлюлозной и хитиновой соответственно) — животные клетки не имеют плотной клеточной стенки.
- В качестве энергетического резерва животные и грибы используют гликоген, растения — крахмал.
- Клетки растений содержат органеллы пластиды, которых нет у животных и грибов.
Вирусы — неклеточные формы жизни
[править]
А. Вирус, не имеющий липидной оболочки (например, пикорнавирус).
B. Оболочечный вирус (например, герпесвирус).
Цифрами обозначены: (1) капсид, (2) геномная нуклеиновая кислота, (3) капсомер, (4) нуклеокапсид, (5) вирион, (6) липидная оболочка, (7) мембранные белки оболочки.
Ви́рус (от лат. virus — яд) — микроскопическая частица, состоящая из белков и нуклеиновых кислот и способная инфицировать клетки живых организмов. Вирусы являются облигатными паразитами — они не способны размножаться вне клетки. В настоящее время известны вирусы, размножающиеся в клетках растений, животных, грибов и бактерий (последних обычно называют бактериофагами). Обнаружен также вирус, поражающий другие вирусы (Вирусы тоже болеют вирусными заболеваниями).

Вирусы представляют собой молекулы нуклеиновых кислот (ДНК или РНК), заключённые в защитную белковую оболочку (капсид). Наличие капсида отличает вирусы от других инфекционных агентов, вироидов. Вирусы содержат только один тип нуклеиновой кислоты: либо ДНК, либо РНК. Ранее к вирусам также ошибочно относили прионы, однако впоследствии оказалось, что эти возбудители представляют собой особые белки и не содержат нуклеиновых кислот.
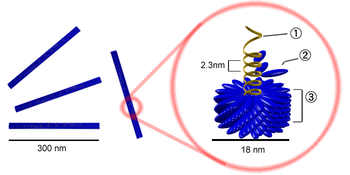
Цифрами обозначены: (1) РНК-геном вируса, (2) капсомер, состоящий всего из одного протомера, (3) зрелый участок капсида.
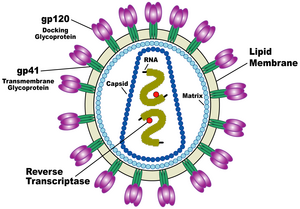
Роль вирусов в биосфере
Вирусы являются одной из самых распространённых форм существования органической материи на планете по численности: воды мирового океана содержат колоссальное количество бактериофагов (около 1011 частиц на миллилитр воды), их общая численность в океане — около 4 х 1030, а численность вирусов (бактериофагов) в донных отложениях океана практически не зависит от глубины и всюду очень высока [16]. В океане обитают сотни тысяч видов (штаммов) вирусов, подавляющее большинство которых не описаны и тем более не изучены [17][18]. Вирусы играют важную роль в регуляции численности популяций животных.
Строение вирионов
Вирусные частицы (вирио́ны) представляют собой белковую капсулу — капсид, содержащую геном вируса, представленный одной или несколькими молекулами ДНК или РНК. Капсид построен из капсомеров — белковых комплексов, состоящих в свою очередь из протомеров. Нуклеиновая кислота в комплексе с белками обозначается термином нуклеокапсид. Некоторые вирусы имеют также внешнюю липидную оболочку. Размеры различных вирусов колеблются от 20 нм (пикорнавирусы) до 500 нм (мимивирусы). Вирионы часто имеют правильную геометрическую форму (икосаэдр, цилиндр). Такая структура капсида предусматривает идентичность связей между составляющими её белками, и, следовательно, может быть построена из стандартных белков одного или нескольких видов, что позволяет вирусу экономить место в геноме.
Фазы вирусной инфекции
[править]Условно процесс вирусного инфицирования в масштабах одной клетки можно разбить на несколько взаимоперекрывающихся этапов:
- Присоединение к клеточной мембране — так называемая адсорбция. Обычно для того, чтобы вирион адсорбировался на поверхности клетки, она должна иметь в составе своей плазматической мембраны белок (часто гликопротеин) — рецептор, специфичный для данного вируса. Наличие рецептора нередко определяет круг хозяев данного вируса, а также его тканеспецифичность.
- Проникновение в клетку. На следующем этапе вирусу необходимо доставить внутрь клетки свою генетическую информацию. Некоторые вирусы привносят также собственные белки, необходимые для её реализации (особенно это характерно для вирусов, содержащих негативные РНК). Различные вирусы для проникновения в клетку используют разные стратегии: например, пикорнавирусы впрыскивают свою РНК через плазматическую мембрану, а вирионы ортомиксовирусов захватываются клеткой в ходе эндоцитоза, попадают в кислую среду лизосом, где происходит их окончательное созревание(депротеинизация вирусной частицы), после чего РНК в комплексе с вирусными белками преодолевает лизосомальную мембрану и попадает в цитоплазму. Вирусы также различаются по локализации их репликации, часть вирусов (например, те же пикорнавирусы) размножается в цитоплазме клетки, а часть (например, ортомиксовирусы) в её ядре.
- Перепрограммирование клетки. При заражении вирусом в клетке активируются специальные механизмы противовирусной защиты. Заражённые клетки начинают синтезировать сигнальные молекулы — интерфероны, переводящие окружающие здоровые клетки в противовирусное состояние и активирующие системы иммунитета. Повреждения, вызываемые размножением вируса в клетке, могут быть обнаружены системами внутреннего клеточного контроля, и такая клетка должна будет «покончить жизнь самоубийством» в ходе процесса, называемого апоптозом или программируемой клеточной смерти. От способности вируса преодолевать системы противовирусной защиты напрямую зависит его выживание. Неудивительно, что многие вирусы (например, пикорнавирусы, флавивирусы) в ходе эволюции приобрели способность подавлять синтез интерферонов, апоптозную программу и так далее. Кроме подавления противовирусной защиты, вирусы стремятся создать в клетке максимально благоприятные условия для развития своего потомства.
Примером перепрограммирования систем клетки-хозяина является трансляция РНК энтеровирусов. Вирусная протеаза расщепляет клеточный белок eIF4G, необходимый для инициации трансляции подавляющего большинства клеточных мРНК (транслирующихся по так называемому кэп-зависимому механизму). При этом инициация трансляции РНК самого вируса происходит другим способом (IRES-зависимый механизм), для которого вполне достаточно отрезанного фрагмента eIF4G. Таким образом, вирусные РНК приобретают эксклюзивные «права» и не конкурируют за рибосомы с клеточными.
- Персистенция. Некоторые вирусы могут переходить в латентное состояние (так называемая персистенция для вирусов эукариот или лизогения для бактериофагов — вирусов бактерий), слабо вмешиваясь в процессы, происходящие в клетке, и активироваться лишь при определённых условиях. Так построена, например, стратегия размножения некоторых бактериофагов — до тех пор пока заражённая клетка находится в благоприятной среде, фаг не убивает её, наследуется дочерними клетками и нередко интегрируется в клеточный геном. Однако при попадании заражённой лизогенным фагом бактерии в неблагоприятную среду, возбудитель захватывает контроль над клеточными процессами так, что клетка начинает производить материалы, из которых строятся новые фаги (так называемая литическая стадия). Клетка превращается в фабрику, способную производить многие тысячи фагов. Зрелые частицы, выходя из клетки, разрывают клеточную мембрану, тем самым убивая клетку. С персистенцией вирусов (например, паповавирусов) связаны некоторые онкологические заболевания.
- Создание новых вирусных компонентов. Размножение вирусов в самом общем случае включает три процесса — 1) транскрипция вирусного генома — то есть синтез вирусной мРНК, 2) её трансляция, то есть синтез вирусных белков и 3) репликация вирусного генома (в некоторых случаях, когда генетическая информация вируса закодирована в виде РНК, геномная РНК одновременно играет роль мРНК, и, следовательно, процесс транскрипции в зараженной клетке не происходит за ненадобностью). У многих вирусов существуют системы контроля, обеспечивающие оптимальное расходование материалов клетки-хозяина. Например, когда вирусной мРНК накоплено достаточно, транскрипция вирусного генома подавляется, а репликация, напротив, активируется.
- Созревание вирионов и выход из клетки. В конце концов, новосинтезированные геномные РНК или ДНК одеваются соответствующими белками и выходят из клетки. Следует сказать, что активно размножающийся вирус не всегда убивает клетку-хозяина. В некоторых случаях (например, ортомиксовирусы) дочерние вирусы отпочковываются от плазматической мембраны, не вызывая её разрыва. Таким образом, клетка может продолжать жить и продуцировать вирус.
- [19] Анимация «Жизненный цикл ВИЧ» (англ. текст)
Классификация Балтимора и жизненные циклы вирусов
[править]Нобелевский лауреат, биолог Дэвид Балтимор, предложил свою схему классификации вирусов, основываясь на различиях в механизме продукции мРНК и связанных с этим особенностях жизненного цикла вирусов. .Эта система включает в себя семь основных групп:
- (I) Вирусы, содержащие двуцепочечную ДНК и не имеющие РНК-стадии (например, герпесвирусы, поксвирусы, паповавирусы, мимивирус).
- (II) Вирусы, содержащие двуцепочечную РНК (например, ротавирусы).
- (III) Вирусы, содержащие одноцепочечную молекулу ДНК (например, парвовирусы).
- (IV) Вирусы, содержащие одноцепочечную молекулу РНК положительной полярности (например, пикорнавирусы, флавивирусы).
- (V) Вирусы, содержащие одноцепочечную молекулу РНК негативной или двойной полярности (например, ортомиксовирусы, филовирусы).
- (VI) Вирусы, содержащие одноцепочечную молекулу РНК и имеющие в своем жизненном цикле стадию синтеза ДНК на матрице РНК, ретровирусы (например, ВИЧ).
- (VII) Вирусы, содержащие двуцепочечную ДНК и имеющие в своем жизненном цикле стадию синтеза ДНК на матрице РНК, ретроидные вирусы (например, вирус гепатита B).
История изучения вирусов
[править]Впервые существование вируса (как нового типа возбудителя болезней) доказал в 1892 году русский учёный Д. И. Ивановский. После многолетних исследований заболеваний растений табака, в работе, датированной 1892 годом, Д. И. Ивановский приходит к выводу, что мозаичная болезнь табака вызывается «бактериями, проходящими через фильтр Шамберлана, которые, однако, не способны расти на искусственных субстратах».
Пять лет спустя, при изучении заболеваний крупного рогатого скота, а именно — ящура, был выделен аналогичный фильтрующийся микроорганизм. А в 1898 году, при воспроизведении опытов Д. Ивановского голландским ботаником М. Бейеринком, он назвал такие микроорганизмы «фильтрующимися вирусами». В сокращённом виде, это название и стало обозначать данную группу микроорганизмов.
В 1901 г. было обнаружено первое вирусное заболевание человека — жёлтая лихорадка. Это открытие было сделано американским военным хирургом У. Ридом и его коллегами.
В 1911 г. Фрэнсис Раус доказал вирусную природу рака — саркомы Рауса (лишь в 1966 г, спустя 55 лет, ему была вручена за это открытие Нобелевская премия по физиологии и медицине).
В последующие годы изучение вирусов сыграло важнейшую роль в развитии эпидемиологии, иммунологии, молекулярной генетики и других разделов биологии. Так, эксперимент Херши-Чейз стал решающих доказательством роли ДНК в передаче наследственных свойств. В разные годы еще как минимум шесть Нобелевских премий по физиологии и медицине и три Нобелевских премии по химии были вручены за исследования, непосредственно связанные с изучением вирусов.
В 2002 году, в университете Нью-Йорка был создан первый синтетический вирус (вирус полиомиелита).
Разнообразие клеток многоклеточного организма
[править]
Многоклеточный организм отличаются от одноклеточных и колониальных четко выраженной дифференциацией функций отдельных групп клеток. Специализация клеток повышает их эффективность в выполнении определённых функций, а их упорядоченность и согласованность действий позволяют целому многоклеточному организму приобретать свойства, недоступные одноклеточным и колониальным организмам.
Клетка в многоклеточном организме во многом действует так же, как и в одноклеточном организме при взаимодействии с внешней средой и клетками окружения. Однако усиление специализации клеток увеличивает и их взаимозависимость от клеток другой специализации.
Важную роль в строении многоклеточного организма играют стволовые клетки. Эти клетки способны делиться асимметрично, порождая клетку, подобную материнской, а также новую клетку, способную дифференцироваться, т.е. приобретать специализированные функции. Стволовые клетки разделяют по способности порождать другие виды клеток. Самыми широкими возможностями обладают т.н. тотипотентные стволовые клетки, такие как зигота и бластомеры, способные дать начало любым типам клеток. Далее, по мере сужения диапазона возможной дифференцировки, различают плюрипотентные, мультипотентные и унипотентные стволовые клетки. В органах и тканях взрослого организма присутствуют стволовые клетки разной степени зрелости и потентности, способные при необходимости превратиться в клетки нужного типа.
Число типов клеток в многоклеточном организме может достигать нескольких сотен. Например, во взрослом организме млекопитающего насчитывается около 350 различных видов клеток. Клетки различаются по размеру, форме, числу ядер, степени развитости органоидов, химическому составу и функциям:
Эритроциты высших позвоночных имеют диаметр 4–7 микрон, а клетки мышц — это крупные синцитии длиной до нескольких сантиметров. Ещё более крупные линейные размеры имеют нейроны с их гигантскими аксонами, достигающими в длину около метра.
Клетки могут иметь разнообразную форму: близкую к шарообразной (клетка крови — лимфоцит), напоминающую многогранник (клетка печени — гепатоцит), звездчатую (клетка костной ткани — остеобласт), цилиндрическую (клетка мерцательного эпителия). У млекопитающих зрелые эритроциты лишены ядер и имеют форму двояковогнутого диска. Монополярные нервные клетки, нейроны, имеют тело размером в несколько десятков микрон и отростки, аксоны, длиной до нескольких десятков сантиметров.
В большинстве клеток имеется одно ядро, и такие клетки называют одноядерными. Существуют также клетки с двумя, тремя, несколькими десятками и даже сотнями ядер. Это — многоядерные клетки. Клетки мышц, например, являются многоядерными клетками (синцитиями), появившимися из одноядерных в процессе эмбриогенеза. А эритроциты в зрелом состоянии не имеют ядра вовсе (это безъядерные клетки).
Органоиды различных клеток многоклеточного организма различаются по степени развитости. Например, в клетках кишечного эпителия лизосомы и аппарат Гольджи развиты лучше, чем в нейронах. А в клетках надпочечника цитоскелет развит слабее, чем в клетках мышечной ткани. Зато клетки надпочечника обладают сильно развитой эндоплазматической сетью; это связано с их секреторной активностью.
В ходе эволюции сходные клетки многоклеточного организма специализировались на выполнении определенных функций, что привело к формированию тканей. Разные ткани объединились в органы, а органы — в системы органов. Функции клеток различных тканей и органов, выполняющих специализированные функции, также существенно различаются. Так, эритроциты выполняют функцию переноса кислорода и углекислого газа, клетки различных эпителиев — защитную, выделительную, всасывающую и разграничительную функции, а нейроны, клетки нервной ткани — функцию восприятия раздражителей, генерации и передачи нервных импульсов.
Специализация клеток происходит вследствие дифференцированной работы генома. Репрессия и дерепрессия конкретных участков генома, а также биохимическая и анатомо-морфологическая дифференциация происходят из-за разной концентрации действующих на клетки сигнальных веществ, питательных веществ и ионов.
-
Общее строение нейрона
-
Фибробласты — клетки соединительной ткани
-
Париетальные клетки желудочных желёз
-
Хлоропласты в растительных клетках
Основные понятия химии и химический состав клеток
[править]Полезные сайты по теме:
- http://repetitors.info/txt/chim/st_chim_def.doc — первоначальные химические понятия (файл в формате .doc)
- [20] — А. В. Мануйлов, В. И. Родионов. Основы химии. Электронный учебник.
- [[21]] ХиМиК.ru
- Портал:Химия — Химический портал Википедии
- [22] — Учебник биохимии (англ.)
- [23] — еще один учебник биохимии (англ.)
Атомы
[править]Атом — наименьшая частица химического элемента
[править]
А́том (др.-греч. ἄτομος — неделимый) — наименьшая частица химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и электрически нейтральных нейтронов, а окружающее его облако состоит из отрицательно заряженных электронов.
Поскольку число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. Атом, который отдал или приобрел электроны, обладает некоторым положительным или отрицательным зарядом и называется ионом (ион может представлять собой и группу атомов — часть молекулы).
Атомы классифицируются по числу протонов и нейтронов в ядре: число протонов определяет принадлежность атома некоторому химическому элементу. Число нейтронов у атомов одного химического элемента может различаться, атомы с одинаковым числом протонов, но разным числом нейтронов называют изотопами данного элемента.
Атомы, связанные межатомными связями, образуют молекулы.
Модели атомов
В разные эпохи предлагались различные модели атомов, наиболее известная из которых — планетарная модель атома Бора-Резерфорда. В 1911 году Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а следовательно, терять энергию. Расчеты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает («модель атома Бора-Резерфорда»). Постулаты Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
Современные представления об атоме
Сегодня общепринятой является модель атома, являющаяся развитием планетарной модели. Считается, что ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами.
Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются c помощью квантовой механикой. Положение атома в таблице Менделеева определяется числом протонов, в то время как число нейтронов принципиально на химические свойства не влияет; при этом нейтронов в ядре, как правило, не меньше, чем протонов (см. атомное ядро). Если атом находится в нейтральном состоянии, то число электронов в нём равно числу протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
Массу атома принято измерять в атомных единицах массы, равных 1/12 от массы атома стабильного изотопа углерода 12C.
Атомы состоят из субатомных частиц
[править]Хотя слово атом в первоначальном значении обозначало частицу, которая не делится на меньшие части, согласно современным представлениям он состоит из более мелких частиц, называемых субатомными частицами. Атом состоит из электронов, протонов, все атомы, кроме водорода-1, содержат также нейтроны.
Электрон является самой лёгкой из составляющих атом частиц с массой 9,11 х 10−28 г, отрицательным зарядом и размером, слишком малым для измерения современными методами. Протоны обладают положительным зарядом и в 1836 раз тяжелее электрона (1,6726 х 10−24 г). Нейтроны не обладают электрическим зарядом и в 1839 раз тяжелее электрона (1,6929 х 10−24 г).
При этом масса ядра меньше суммы масс составляющих её протонов и нейтронов из-за эффекта дефекта массы. Нейтроны и протоны имеют сравнимый размер, около 2,5 х 10−15 м, хотя размеры этих частиц определены плохо.
В стандартной модели элементарных частиц как протоны, так и нейтроны состоят из элементарных частиц, называемых кварками. Наряду с лептонами, кварки являются одной из основных составляющих материи. И первые и вторые являются фермионами. Существует шесть типов кварков, каждый из которых имеет дробный электрический заряд, равный +2/3 или −1/3 элементарного. Протоны состоят из двух u-кварков и одного d-кварка, а нейтрон — из одного u-кварка и двух d-кварков. Это различие объясняет разницу в массах и зарядах протона и нейтрона. Кварки связаны между собой сильными ядерными взаимодействиями, которые передаются глюонами.
Размер атомов в миллионы раз меньше размеров клеток
[править]Атомы не имеют отчётливо выраженной внешней границы, поэтому их размеры часто определяют по расстоянию между ядрами соседних атомов, которые образовали химическую связь. Половина этого расстояния — радиус атома.
Есть и другой вариант определения радиуса атома (см. статью Размер атомов).
В периодической системе элементов размер атома увеличивается при движении сверху вниз по столбцу и уменьшается при движении по строке слева направо. Соответственно, самый маленький атом — это атом гелия, имеющий радиус 32 пм, а самый большой — атом цезия (225 пм). Эти размеры в тысячи раз меньше длины волны видимого света (400—700 нм), поэтому атомы нельзя увидеть в оптический микроскоп. Однако отдельные атомы можно наблюдать (например, на поверхности металлов) с помощью сканирующего туннельного микроскопа. Диаметр ядра атома примерно в 100.000 раз меньше диаметра самого атома.
Радиус зависит от положения атома, его типа, вида химической связи, числа ближайших атомов (координационного числа) и квантово-механического свойства, известного как спин.
Малость атомов демонстрируют следующие примеры. Человеческий волос по толщине в миллион раз больше атома углерода. Толщина человеческого волоса примерно 105 нм, а 10 углеродных атомов, выстроенных в цепочку, по толщине составляют 1 нм. Одна капля воды содержит 2 x 10 21 атомов кислорода и в два раза больше атомов водорода. Если бы яблоко можно было увеличить до размеров Земли, то атомы достигли бы исходных размеров яблока.
Клетка мелкой бактерии имеет объем около 1 мкм³. Даже в такой мелкой клетке содержится несколько миллионов атомов.
Электронные орбитали и энергетические уровни
[править]См. статью Атомная орбиталь См. статью Энергетический уровень
Когда электрон находится в связанном состоянии в атоме, он обладает потенциальной энергией, которая обратно пропорциональна его расстоянию от ядра. Эта энергия обычно измеряется в электронвольтах (эВ) и равна энергии, которую надо передать электрону, чтобы сделать его свободным (оторвать от атома). Согласно квантовомеханической модели атома связанный электрон может занимать только дискретный набор разрешённых энергетических уровней — состояний с определённой энергией. Наинизшее из разрешённых энергетических состояний называется основным, а все остальные — возбуждёнными.
Для перехода электрона с одного энергетического уровня на другой нужно передать ему или отнять у него энергию. Это происходит путём соответственно поглощения или испускания фотона, причём энергия этого фотона равна абсолютной величине разности энергий начального и конечного уровней электрона. Энергия испущенного фотона пропорциональна его частоте, поэтому переходы между разными энергетическими уровнями проявляются в различных областях электромагнитного спектра. Каждый элемент имеет уникальный спектр испускания, который зависит от заряда ядра, заполнения электронных подоболочек, взаимодействия электронов, а также других факторов.
Когда излучение с непрерывным спектром проходит через вещество (например, газ или плазму), некоторые фотоны поглощаются атомами или ионами, вызывая электронные переходы между энергетическим состояниями, разность энергий которых равна энергии поглощённого фотона. Затем эти возбуждённые электроны спонтанно переходят на уровень, лежащий ниже по энергии, снова испуская фотоны. Таким образом, вещество ведёт себя как фильтр, превращая исходный непрерывный спектр в спектр поглощения, в котором имеются серии тёмных полос. При наблюдении с тех углов, куда не направлено исходное излучение, можно заметить излучение с спектр испускания, излучаемого атомами. Спектроскопический анализ — измерения энергии, амплитуды и ширины спектральных линий излучения — позволяют определить вид излучающего вещества и физические условия в нём.
Электроны в атоме притягиваются к протонам, находящимся в ядре, под действием электромагнитных сил. Для того, чтобы электрон смог преодолеть притяжение ядра, ему необходимо передать энергию от внешнего источника. Чем ближе электрон находится к ядру, тем больше энергии для этого необходимо.
Электромагнитные силы удерживают электроны внутри потенциального барьера, окружающего ядро.
Электронам, как и другим субатомным частицам, свойственен корпускулярно-волновой дуализм — они представляют собой одновременно и частицу, и волну. В электронном облаке электронам соответствуют трёхмерные стоячие волны, не изменяющие своей формы с течением времени относительно ядра. Говорят, что электрон движется по орбитали. Существует дискретный набор таких орбиталей, и электроны могут находиться длительное время только в этих состояниях, так как они наиболее устойчивые.
На самом же деле это состояние описывают волновой функцией, квадрат которой характеризует плотность вероятности нахождения частицы в данной точке пространства в данный момент времени.
Каждой орбитали соответствует свой уровень энергии. Электрон может перейти на уровень с большей энергией (новую орбиталь), поглотив фотон — квант света. При этом он окажется в новом состоянии с большей энергией. Аналогично, он может перейти на уровень с меньшей энергией, излучив фотон. Энергия фотона при этом будет равна разности энергий электрона на этих уровнях (см. постулаты Бора).
Главное (радиальное) квантовое число — целое число, обозначающее номер энергетического уровня. Характеризует энергию электронов, занимающих данный энергетический уровень. Оно обозначается как . При увеличении главного квантового числа возрастают радиус орбитали и энергия электрона.
Наибольшее число электронов на энергетическом уровне, с учетом спина электрона, определяется по формуле , где N — число электронов на уровне, а n — главное квантовое число (номер уровня). Таким образом, на первом энергетическом уровне может находиться максимум 2 электрона, на втором — 8, на третьем — 18 и т. п. На каждом энергетическом уровне орбиталей вдвое меньше, чем электронов (1 орбиталь на первом уровне, 3 — на втором, 9 — на третьем). На каждой орбитали может находиться максимум по два электрона, отличающихся спином. Участвуют в образовании химических связей и определяют химические свойства атомов данного химического элемента почти исключительно электроны внешнего (самого далекого от ядра) электронного уровня.
Главное квантовое число является первым в ряду квантовых чисел, который включает в себя главное, орбитальное и магнитное квантовые числа, а также спин. Эти четыре квантовые числа определяют уникальное состояние электрона в атоме (его волновую функцию).
При увеличении номера элемента (числа протонов в ядре) растёт и число электронов. В какой последовательности они занимают электронные орбитали? Оказывается, чем меньше энергия данной орбитали, тем «быстрее» она заполняется электронами. Если же есть несколько орбиталей с равными энергиями, то электроны «стремятся» располагаться на них поодиночке, если есть такая возможность.
Электронная оболочка атома — область пространства вероятного местонахождения электронов, характеризующихся одинаковым значением главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях. Каждая электронная оболочка может иметь определённое максимальное число электронов.
Электронные оболочки обозначаются буквами s, p, d, f, g или цифрами от 0 до 4. Электроны внешних оболочек обладают большей энергией, и, по сравнению с электронами внутренних оболочек, находятся дальше от ядра, что делает их более важными в анализе поведения атома в химических реакциях и в роли проводника, так как их связь с ядром слабее и легче разрывается.
Подуровни оболочек
Каждая оболочка состоит из одного или нескольких подуровней, каждый из которых состоит из атомных орбиталей. К примеру, первая оболочка (K) состоит из одного подуровня «1s». Вторая оболочка (L) состоит из двух подуровней, 2s и 2p. Третья оболочка — из «3s», «3p» и «3d». Возможные варианты подуровней оболочек приведены в следующей таблице:
| Обозначение подуровня | l | Макс. кол-во электронов | Содержание в оболочках | Историческое наименование |
|---|---|---|---|---|
| s | 0 | 2 | В каждой | sharp |
| p | 1 | 6 | Во всех, начиная со 2 | principal |
| d | 2 | 10 | Во всех, начиная с 3 | diffuse |
| f | 3 | 14 | Во всех, начиная с 4 | fundamental |
| g | 4 | 18 | Во всех, начиная с 5 | |
| h | 5 | 22 | Во всех, начиная с 6 | |
| i | 6 | 26 | Во всех, начиная с 7 |
Валентные оболочки
Валентная оболочка — самая внешняя оболочка атома. Электроны этой оболочки зачастую называют валентными электронами, так как в основном именно эти электроны определяют поведение атома в химических реакциях. При образовании химических связей атомы «стремятся» заполнить свои внешние валентные оболочки.
С точки зрения химической активности, наименее активными считаются атомы, в которых валентная оболочка окончательно заполнена (инертные газы). Наибольшей химической активностью обладают атомы, в которых валентная оболочка состоит всего из одного электрона (щелочные металлы), и атомы, в которых одного электрона не хватает для окончательного заполнения оболочки (галогены).
На самом деле всё немного сложнее. Поведение атома в химических реакциях определяют электроны, обладающие большей энергией, то есть те электроны, которые расположены дальше от ядра. Электроны внутренних подуровней оболочек имеют меньшую энергию, чем электроны внешних подуровней. Несмотря на то, что электроны подуровня оболочки 3d могут не принадлежать к т. н. валентной оболочке, они могут иметь энергию большую, чем электроны подуровня оболочки 4s, что делает их валентными электронами (см. Валентные электроны и валентность).
Чтобы показать повторяющиеся химические свойства химических элементов, их упорядочивают в виде периодической таблицы (таблицы Менделеева). Элементы с одинаковым числом валентных электронов формируют группу, которая изображается в таблице в виде столбца (движение по горизонтальному ряду соответствуют заполнению валентной оболочки электронами). Элементы, находящиеся в самом правом столбце таблицы, имеют полностью заполненную электронами внешнюю оболочку, поэтому они отличаются крайне низкой химической активностью и называются инертными, или благородными газами.
Порядок заполнения электронных оболочек
Порядок заполнения электроннных оболочек (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется правилом Хунда.
Для начала разберемся в заполнении двух первых энергетических уровней. На первом уровне всего одна орбиталь (1s), на которой могут располагаться максимум два электрона. Энергия этой орбитали у любого атома ниже, чем у всех остальных орбиталей, поэтому она всегда заполняется первой. На втором уровне имеется четыре орбитали — 2s, 2px, 2py и 2pz. Сначала целиком заполняется 2s орбиталь (ее энергия меньше, чем у 2p-орбиталей). Затем заполняются p-орбитали. У них энергия равная, поэтому сначала электроны располагаются на них поодиночке. Так, у элемента N 7 (азот) электронная формула, которая описывает распределение электронов по орбиталям, будет 1s2 2s2 2px1 2py1 2pz1. Это означает, что по два электрона находятся на двух s-орбиталях и по одному — на каждой из трех p-орбиталей (см.[[24]].
- Вопрос 1
- Какова электронная формула элемента №6 (углерода)?
- Вопрос 2
- Сколько валентных электронов у бора? У углерода?
По определению, любые два атома с одним и тем же числом протонов в их ядрах относятся к одному химическому элементу. Итак, химический элемент — это сорт атомов с определенным числом протонов в ядре.
На июнь 2009 года известно 117 химических элементов (с порядковыми номерами с 1 по 116 и 118), из них 94 обнаружены в природе (некоторые — лишь в следовых количествах), остальные 23 получены искусственно в результате ядерных реакций.
Первые 112 элементов имеют постоянные названия, остальные — временные. Открытие 112-го элемента (самый тяжелый из официальных) признано Международным союзом теоретической и прикладной химии (en:International Union for Pure and Applied Chemistry). Самый стабильный из известных изотопов данного элемента имеет период полураспада 34 секунды. На начало июня 2009 года носит неофициальное имя унунбий, был впервые синтезирован в феврале 1996 года на ускорителе тяжелых ионов в Институте тяжелых ионов (Gesellschaft für Schwerionenforschung, GSI) в Дармштадте, Германия (в результате бомбардировки свинцовой мишени ядрами цинка). Первооткрыватели имеют полгода, чтобы предложить новое официальное название для добавления в таблицу (ими уже предлагались Виксхаузий, Гельмгольций, Венусий, Фриший, Штрассманий и Гейзенбергий). В настоящее время известны трансурановые элементы с номерами 113—116 и 118, полученные в Объединенном институте ядерных исследований в Дубне, однако они официально пока не признаны.
Химические символы Символы химических элементов используются как сокращения для названия элементов. В качестве символа обычно берут начальную букву названия элемента и в случае необходимости добавляют следующую или одну из следующих. Обычно это начальные буквы латинских названий элементов: Cu — медь (cuprum), Ag — серебро (argentum), Fe — железо (ferrum), Au — золото (aurum), Hg — ртуть (hydrargirum).
Пока Вам необходимо запомнить символы следующих элементов:
- C — углерод
- H — водород
- O — кислород
- N — азот
- S — сера
- P — фосфор
- K — калий
- Ca — кальций
- Mg — магний
- Fe — железо
- Cl — хлор
Карточка химического элементавключает краткую информацию о его свойствах. На рисунке показана карточка рутения.
- 1 — обозначение химического элемента.
- 2 — русское название.
- 3 — порядковый номер химического элемента, равный количеству протонов в атоме.
- 4 — атомная масса.
- 5 — распределение электронов по энергетическим уровням.
- 6 — электронная конфигурация.
Атомы с одним и тем же количеством протонов, но разным количеством нейтронов называют изотопами данного элемента. Например, атомы водорода всегда содержат один протон, но существуют изотопы без нейтронов (водород-1, иногда также называемый протием — наиболее распространённая форма), с одним нейтроном (дейтерий) и двумя нейтронами (тритий).
Известные элементы составляют непрерывный натуральный ряд по числу протонов в ядре, начиная с атома водорода с одним протоном и заканчивая атомом унуноктия, в ядре которого 118 протонов.
Поскольку наибольший вклад в массу атома вносят протоны и нейтроны, полное число этих частиц называют массовым числом. Массу покоя атома часто выражают в атомных единицах массы (а. е. м.), которая также называется дальтоном (Да). Эта единица определяется как 1/12 часть массы покоя нейтрального атома обычного изотопа углерода — углерода-12, которая приблизительно равна 1,66 x 10−24 г. Масса атома приблизительно равна произведению массового числа на атомную единицу массы.
Водород-1 — наилегчайший изотоп водорода и атом с наименьшей массой, он имеет атомную массу около 1,007825 а. е. м.
Атомная масса химического элемента (также «средняя атомная масса», «стандартная атомная масса») является средневзвешенной атомной массой всех стабильных изотопов данного химического элемента с учётом их природной распространённости в земной коре и атмосфере. Например, хлор в природных соединениях находится в виде двух изотопов: 35Cl (75,5 % массы) и 37Cl (24,5 % массы). Среднюю атомную массу природного хлора равна 0,755∙35 + 0,245∙37 = 35,5
Именно эта атомная масса представлена в периодической таблице Д. И. Менделеева, её используют в стехиометрических расчётах.
Моль (единица количества вещества)
Так как массы даже самых тяжёлых атомов в обычных единицах (например, в граммах) очень малы, то в химии для измерения этих масс используют моли.
В одном моле любого вещества по определению содержится одно и тоже число атомов или иных частиц (молекул, ионов)— примерно 6,022×1023. Это число (число Авогадро) выбрано таким образом, что если масса элемента равна 1 а. е. м., то моль атомов этого элемента будет иметь массу 1 г. Например, углерод (точнее, изотоп углерод-12)имеет массу 12 а. е. м., поэтому 1 моль углерода весит 12 г.
Моль — одно из важнейших для химии понятий, и вот почему. Химические вещества вступают в химические реакции в определенных соотношениях, которые определяются их формулами. Например, при реакции горения водорода образуется вода. При этом в конечном продукте (Н2О) на каждый атом кислорода приходится два атома водорода. Значит, если мы хотим, чтобы исходные вещества целиком израсходовались в ходе реакции (ни одно из них не оказалось в избытке), на каждые два атома водорода нужно взять один атом кислорода. Но как это сделать? Нужно взять 1 моль кислорода и 2 моля водорода (или 0,1 моль кислорода и 0,2 моля водорода — важно соотношение 1:2). А это можно сделать, зная молекулярную массу кислорода O2(32 Да) и водорода H2(2 Да). Молекулярную массу легко перевести в молярную массу.
Моля́рная ма́сса вещества — масса одного моль вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента. В этом случае молярная масса элемента, выраженная в г/моль, численно совпадает с массой атома элемента, выраженной в а.е.м. (атомная единица массы). Однако надо четко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности.
Молярные массы сложных молекул можно определить, суммируя молярные массы входящих в них элементов. Например, молярная масса воды (H2O) есть MH2O = 2 MH +MO = 2·1+16 = 18 (г/моль).
- Вопрос 1
- Так сколько же грамм кислорода и водорода нужно взять, чтобы получить 96 г воды и чтобы при горении ни одно вещество не оказалось в избытке?
У каждого химического элемента есть один или более изотопов с нестабильными ядрами, которые подвержены радиоактивному распаду, в результате чего атомы испускают частицы или электромагнитное излучение. Радиоактивность возникает, когда радиус ядра больше радиуса действия сильных взаимодействий (расстояний порядка 1 фм.
Существуют три основные формы радиоактивного распада:
- Альфа-распад происходит, когда ядро испускает альфа-частицу — ядро атома гелия, состоящее из двух протонов и двух нейтронов. В результате испускания этой частицы возникает элемент с меньшим на два атомным номером.
- Бета-распад происходит из-за слабых взаимодействий, и в результате нейтрон превращается в протон или наоборот. В первом случае происходит испускание электрона и антинейтрино, во втором — испускание позитрона и нейтрино. Электрон и позитрон называют бета-частицами. Бета-распад увеличивает или уменьшает атомный номер на единицу.
- Гамма-излучение происходит из-за перехода ядра в состояние с более низкой энергией с испусканием электромагнитного излучения. Гамма-излучение может происходить вслед за испусканием альфа- или бета-частицы после радиоактивного распада.
Каждый радиоактивный изотоп характеризуется периодом полураспада, то есть временем, за которое распадается половина ядер образца. Количество оставшихся ядер уменьшается экспоненциально — вдвое за каждый период полураспада. Например, по прошествии двух периодов полураспада в образце останется только 25 % ядер исходного изотопа.
Радиоактивный распад играет важную роль в жизни организмов и в современных методах их исследования. Во-первых. разные виды ионизирующего излучения оказывают воздействие на все живые клетки, являются важным источником мутаций и других поверждений макромолекул. Во-вторых, метод меченых атомов (радиоизотопный метод) широко использщуется для исследования биохимических и молекулярно-биологических процессов, происходящих в клетках. В-третьих, в медицине (в особенности в онкологии) широко используются методы радиотерапии. Наконец, только с появлением радиоизотопного анализа появилась возможность определять абсолютный возраст горных пород, что играет важную роль в геологии и палеонтологии (см.[[25]]).
Валентность (от лат. valens — имеющий силу) — способность атомов химических элементов образовывать химические связи с атомами других элементов. В свете строения атома валентность — это способность атомов отдавать или присоединять определенное число электронов. В соединениях, образованных при помощи ионных связей, валентность атомов определяется числом присоединенных или отданных электронов. В соединениях с ковалентными связями валентность атомов определяется числом образовавшихся «общих» электронных пар.
Однако в настоящее время весьма затруднительно найти единую меру для характеристики способности атома к образованию химической связи. Существуют разные количественные характеристики способности атомов соединяться друг с другом: понятие валентности (ковалентности), понятие степени (состояния) окисления и понятие координационного числа.
Валентности некоторых химических элементов
- Водород, калий, натрий, хлор, фтор — I.
- Кислород, кальций, магний — II
- Алюминий, хром — III.
- Углерод в органических соединениях — IV.
Валентные электроны и валентность
[править]В химии валентными электронами называют электроны, находящиеся на внешней, или валентной, оболочке атома. Валентные электроны определяют поведение химического элемента в химических реакциях. Чем меньше валентных электронов имеет элемент, тем легче он отдаёт эти электроны (проявляет свойства восстановителя) в реакциях с другими элементами. И наоборот, чем больше валентных электронов содержится в атоме химического элемента, тем легче он приобретает электроны (проявляет свойства окислителя) в химических реакциях при прочих равных условиях. Полностью заполненные внешние электронные оболочки имеют инертные газы, которые проявляют минимальную химическую активность. Периодичность заполнения электронами внешней электронной оболочки определяет периодическое изменение химических свойств элементов в таблице Менделеева.
Валентность элемента часто совпадает с числом валентных электронов (например, у щелочных металлов 1 валентный электрон, и валентность у них всегда I, у щелочноземельных металлов) 2 валентных электрона, и валентность у них II) или с числом электронов, которых не хватает до заполнения внешнего уровня (например, у галогенов до заполнения внешнего уровня не хватает одного электрона, и валентность у них I).
У части элементов встречается переменная валентность — в зависимости от того, с какими элементами он вступает в соединения и какие молекулы при этом образуются. Так, азот может иметь валентности I, II, III, IV и V (а степени окисления — −3, −2, −1, +1, +2, +3, +4, +5).
Рассмотрение причин этого выходит за рамки данного учебника. Интересующиеся этой темой могут воспользоваться электронным учебником химиии [26]
Электроотрицательность (χ) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле притягивать к себе общие электронные пары.
Современное понятие об электроотрицательности атомов было введено американским химиком Л. Полингом. Л. Полинг использовал понятие электроотрицательности для объяснения того факта, что энергия гетероатомной связи A—B (A, B — символы любых химических элементов) в общем случае больше среднего геометрического значения гомоатомных связей A—A и B—B. В настоящее время для определения электроотрицательностей атомов существует много различных методов, результаты которых хорошо согласуются друг с другом, за исключением относительно небольших различий, и во всяком случае внутренне непротиворечивы.
Первая и широко известная шкала относительных атомных электроотрицательностей Полинга охватывает значения от 0,7 для атомов цезия до 4,0 для атомов фтора. Фтор — наиболее электроотрицательный элемент, за ним следует кислород (3,5) и далее азот и хлор (3,0). Активные щелочные и щёлочноземельные металлы имеют наименьшие значения электроотрицательности, лежащие в интервале 0,7—1,2, а галогены — наибольшие значения, находящиеся в интервале 4,0—2,5. Электроотрицательность типичных неметаллов находится в середине общего интервала значений и, как правило, близка к 2 или немного больше 2. Электроотрицательность водорода принята равной 2,1. Для большинства переходных металлов значения электроотрицательности лежат в интервале 1,5—2,0. Близки к 2,0 значения электроотрицательностей тяжёлых элементов главных подгрупп. Существует также несколько других шкал электроотрицательности, в основу которых положены разные свойства веществ. Но относительное расположение элементов в них примерно одинаково.
Молекулы
[править]Моле́кула (новолатинское molecula, уменьшительное от moles} — масса) — наименьшая частица вещества, несущая его химические свойства. Молекула состоит из двух или более атомов, характеризуется количеством входящих в неё атомных ядер и электронов, а также определённой структурой.
Нередко (особенно в физике) говорят про одноатомные молекулы инертных газов или идеального газа. Нужно иметь в виду, что далеко не все вещества состоят из молекул!
Обычно подразумевается, что молекулы нейтральны (не несут электрических зарядов) и не несут неспаренных электронов (все валентности насыщены); заряженные молекулы называют ионами, молекулы с мультиплетностью, отличной от единицы (то есть с неспаренными электронами и ненасыщенными валентностями) — радикалами.
Молекулы, образованные сотнями или тысячами атомов, называются макромолекулами. Особенности строения молекул определяют физические и химические свойства вещества, состоящего из этих молекул.
Молекулы состоят из атомов, расположение которых в молекуле передаёт структурная формула (для передачи состава используется т. н. брутто-формула).
Хими́ческая фо́рмула — отражение информации о составе и структуре веществ с помощью химических знаков, чисел (индексов) и разделяющих знаков — скобок.
В настоящее время различают следующие виды химических формул:
- Простейшая формула. Может быть получена опытным путем через определение соотношения химических элементов в веществе с применением значений атомной массы элементов. Так, простейшая формула воды будет H2O, а простейшая формула бензола СН. Атомы в формулах обозначаются знаками химических элементов, а относительное их количество — числами в формате нижних индексов.
- Истинная формула. Может быть получена, если известна молекулярная масса вещества. Истинная формула воды Н2О, что совпадает с простейшей. Истинная формула бензола С6Н6, что отличается от простейшей. Истинные формулы также называют брутто-формулами или эмпирическими. Они отражают состав, но не структуру молекул вещества.
- Рациональная формула. В рациональных формулах выделяются группы атомов, характерные для классов химических соединений. Например, для спиртов выделяется группа -ОН. При записи рациональной формулы такие группы атомов заключаются в круглые скобки (ОН). Количество повторяющихся групп обозначаются числами в формате нижних индексов, которые ставятся сразу за закрывающей скобкой. Квадратные скобки применяются для отражения структуры комплексных соединений. Например, К4[Co(CN)6] — гексацианокобальтоат калия. Рациональные формулы часто встречаются в полуразвернутом виде, когда часть одинаковых атомов показывается по отдельности для лучшего отражения строения молекулы вещества.
- Структурная формула. В графическом виде показывает взаимное расположение атомов в молекуле. Химические связи между атомами обозначаются линиями. Различают двухмерные (2D) и трехмерные (3D) формулы. Двухмерные представляют собой отражение структуры вещества на плоскости. Трехмерные позволяют наиболее близко к теоретическим моделям строения вещества представлять его состав, взаимное расположение, связи и расстояния между атомами.
Пример: Этанол (этиловый спирт):
- Простейшая формула С2Н6О
- Истинная, эмпирическая, или брутто-формула: С2Н6О
- Рациональная формула: С2Н5ОН
- Рациональная формула в полуразвернутом виде: СН3СН2ОН
Структурная формула этанола (2D):
Видя перед собой структурную формулу этанола, мы можем определить валентности входящих в его состав атомов. Число отходящих от атома линий (химических связей) — это и есть его валентность.
О других способах представления структурных формул см. Structural formula
Отнюдь не все химические вещества построены из молекул. Так, многие вещества имеют ионную (NaCl — поваренная соль), металлическую (Fe — железо) или атомную (С — углерод, например, алмаз или графит) кристаллическую решетку (см.[[27]]). Эти вещества не состоят из молекул! (Есть и вещества с молекулярной кристаллической решеткой — например, иод (I2). В определенных условиях можно получить кристаллы белков или ДНК).
В итоге мы видим, что первоначальное определение (мельчайшая частица вещества, сохраняющая его (химические) свойства — весьма неточное. Отдельная молекула не имеет ни части химических, ни, тем более, физических свойств вещества, а некоторые вещества (естественно. имеющие химические свойства) «не имеют» молекул… Было предложено более точное определение: «Молекула — электронейтральная частица вещества, представляющая собой замкнутую совокупность конечного числа атомов, связанных между собой силами ковалентной связи и образующих определённую структуру.»
Молекулы являются объектом изучения теории строения молекул, квантовой химии, аппарат которых активно использует достижения квантовой физики, в том числе релятивистских её разделов. Также в настоящее время развивается такая область химии, как молекулярный дизайн. Для определения строения молекул конкретного вещества используются разные методы: электронная спектроскопия, колебательная спектроскопия, ядерный магнитный резонанс и электронный парамагнитный резонанс и многие другие. Однако единственными прямыми методами в настоящее время являются дифракционные методы: рентгеноструктурный анализ и дифракция нейтронов.
- [[28]] — Строение молекул (Наглядная биохимия)
- Статья «Молекула» в Физической энциклопедии
Химическая реакция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются, в частности не изменяется их общее число и изотопный состав химических элементов.
Важнейшая особенность химических реакций состоит в том, что в ходе них атомы не появляются, не исчезают и не превращаются друг в друга. Это означает. что сколько атомов каждого из элементов было в начале реакции, столько же их останется в конце. На этом основано составление химических уравнений.
Порядок составления химического уравнения
1. Определяем, какие вещества вступают (исходные) в реакцию и какие получаются в её результате (продукт реакции).
- Например: простое вещество медь Cu при прокаливании в кислороде O2 реагирует с ним, в результате чего получается оксид меди CuO — сложное вещество.
2. Химическое уравнение состоит из двух частей.
- В левой части пишут формулы исходных веществ (реагентов), в правой — полученные вещества (продукты реакции). Между исходными веществами и продуктами реакции ставят знак «превращения» (→). Если в левой или правой стороне по несколько веществ, между нами ставят плюс (+).
- Пример: Cu + O2 (исходные вещества) → CuO (продукт реакции).
3. Расставляем коэффициенты так, чтобы число атомов каждого элемента в обеих частях уравнения было одинаково (подбор коэффициентов; уравнивание).
- Пример: 2Cu + O2 → 2CuO
Некоторые химические реакции происходят при смешении или физическом контакте реагентов самопроизвольно. Другие реакции начинаются только при нагревании, участии катализаторов (катализ), действии света (фотохимические реакции), электрического тока (электродные процессы), ионизирующих излучений (радиационно-химические реакции), механического воздействия (механохимические реакции), в низкотемпературной плазме (плазмохимические реакции) и т. п. Самопроизвольное превращение веществ осуществляется при условии, что они обладают энергией, достаточной для преодоления потенциального барьера, разделяющего исходное и конечное состояния системы (см. Энергия активации).
Все химические реакции сопровождаются тепловыми эффектами. При разрыве химических связей в реагентах выделяется энергия, которая, в основном, идет на образование новых химических связей. В некоторых реакциях энергии этих процессов близки, и в таком случае общий тепловой эффект реакции приближается к нулю. В остальных случаях можно выделить
- экзотермические реакции, которые идут с выделением тепла, например, горение водорода и другие реакции горения, и
- эндотермические реакции, в ходе которых тепло поглощается из окружающей среды.
Тепловой эффект реакции (энтальпию реакции, ΔH), часто имеющий очень важное значение, можно вычислить по закону Гесса, если известны энтальпии образования реагентов и продуктов. Когда сумма энтальпий продуктов меньше суммы энтальпий реагентов (ΔrH < 0), наблюдается выделение тепла, в противном случае (ΔrH > 0) — поглощение [29].
В живых клетках некоторые реакции протекают с поглощением энергии (эндергонические реакции), а некоторые — с выделением энергии (экзергонические). Реакции, идущие с поглощением энергии, не могут протекать самопроизвольно — они сопрягаются в клетках с экзергоническими реакциями (см.Обмен веществ и превращения энергии в клетках
См. также
Типы химической связи
[править]Химическая связь — явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы.
История
Термин «химическое строение» впервые ввёл А. М. Бутлеров в 1861 году. Также он заложил основы теории химического строения. Главные положения этой теории следующие:
- Атомы в молекулах соединены друг с другом в определенной последовательности. Изменение этой последовательности приводит к образованию нового вещества с новыми свойствами.
- Соединение атомов происходит в соответствии с валентностью.
- Свойства веществ зависят не только от их состава, но и от «химического строения», то есть от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой.
Основные типы химической связи —
Ковалентной связью называется химическая связь, образующаяся за счёт обобществления атомами своих валентных электронов. Обязательным условием образования ковалентной связи является перекрывание атомных орбиталей (АО), на которых расположены валентные электроны. Различают две основные разновидности ковалентной связи:
- Ковалентная неполярная связь образуется между атомами неметалла одного и того же химического элемента. Такую связь имеют простые вещества, например О2; N2; C12.
- Ковалентная полярная связь образуется между атомами различных неметаллов (например, она присутствует в молекулах CO, NH3, H2O).
В случае, например, с HCl общая электронная плотность оказывается смещенной в сторону хлора, который обладает большей электроотрицательностью, в результате чего на атоме хлора возникает частичный отрицательный заряд, а на атоме водорода — частичный положительный.
В простейшем случае перекрывание двух АО приводит к образованию двух молекулярных орбиталей (МО): связывающей МО и антисвязывающей (разрыхляющей) МО. Обобществленные электроны располагаются на более низкой по энергии связывающей МО/
Ионная связь — прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом.
Так как ионная связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (разность ЭО > 1.7 по Полингу), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:
А• + •В = А+ + [:В]-
ионы
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %.

Ионная связь между атомами в чистом виде не реализуется нигде или почти нигде, обычно на деле связь носит частично ионный, а частично ковалентный характер. В то же время связь сложных молекулярных ионов часто может считаться чисто ионной. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов.
Для соединений с ионной связью характерна хорошая растворимость в полярных растворителях (вода, кислоты и т. д.). Это происходит из-за заряженности ионов. При этом диполи растворителя притягиваются к заряженным ионам, и, в результате броуновского движения, «растаскивают» кристаллическую решетку вещества вещества на ионы и окружают их, не давая соединиться вновь. В итоге получается раствор, в котором ионы окружены диполями растворителя.
Атом водорода, соединенный с атомом сильно электроотрицательного элемента, способен к образованию еще одной химической связи с другим сильно электроотрицательным атомом. Эта связь называется водородной. Результатом таких взаимодействий являются комплексы RA-H•••BR различной степени стабильности, в которых атом водорода выступает в роли мостика, связывающего молекулы или их фрагменты RA и BR.
В образовании водородной связи принимают участие атомы водорода -ОН, =NH и -SH-гpупп (доноров водородной связи) и атомы-акцепторы (например, О, N или S), имеющие свободную пару электронов.
Возникновение водородной связи можно в первом приближении объяснить действием электростатических сил. Атом с большой электроотрицательностью, например, фтор в молекуле HF смещает на себя электронное облако, приобретая значительный эффективный отрицательный заряд, а ядро атома водорода (протон) почти лишается электронного облака и приобретает эффективный положительный заряд. Между протоном атома водорода и отрицательно заряженным атомом фтора соседней молекулы возникает электростатическое притяжение, что и приводит к образованию водородной связи.
Энергия водородной связи составляет 10-40 кДж/моль, что значительно (в 10-40 раз) меньше энергии обычной ковалентной связи. Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак.
Водородная связь в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты. Часто в макромолекулах образуются многочисленные внутримолекулярные водородные связи, которые определяют, например, вторичную структуру белков.
Интересные факты
Именно водородные связи в значительной степени определяют высокую упорядоченность строения и чрезвычайно высокую прочность кевлара.
- В. В. Москва. Водородная связь в органической химии. Соросовский образовательный журнал, 11999,N 2, с.58-64 [32]
Ио́н (греч. ιόν — «идущий») — одноатомная или многоатомная электрически заряженная частица, образующаяся в результате потери или присоединения одного или нескольких электронов атомами или молекулами. Заряд иона кратен заряду электрона.
Понятие и термин ион ввёл в 1834 г Майкл Фарадей, который, изучая действие электрического тока на водные растворы кислот, щелочей и солей, предположил, что электропроводность таких растворов обусловлена движением ионов.
Положительно заряженные ионы, движущиеся в растворе к отрицательному полюсу (катоду), Фарадей назвал катионами, а отрицательно заряженные, движущиеся к положительному полюсу (аноду) — анионами.
В виде самостоятельных частиц они встречаются во всех агрегатных состояниях вещества — в газах (в частности, в атмосфере), в жидкостях (в расплавах и растворах), в кристаллах и в плазме.
Являясь химически активными частицами, ионы вступают в реакции с атомами, молекулами и между собой. В растворах ионы образуются в результате электролитической диссоциации и обусловливают свойства электролитов.
Цвиттер-ион (биполярный ион) (от нем. Zwitter — гибрид, гермафродит) — молекула, которая, являясь в целом электронейтральной, в своей структуре имеет части, несущие как отрицательный, так и положительный заряды, локализованные на разных атомах. Цвиттер-ионы относятся к полярным веществам и, как правило, обладают хорошей растворимостью в воде и слабой — в большинстве органических растворителей. Многие органические молекулы (например, аминокислоты и белки) представляют собой цвиттер-ионы.
Существует 3 теории кислот и оснований — их создали Сванте Аррениус, Й. Н. Брёнстед и Г. Н. Льюис.
Теория Аррениуса
Согласно теории Аррениуса, кислоты- это вещества, при электролитической диссоциации в водном растворе образующие катионы водорода Н+ и анионы кислотного остатка. Основания — это вещества, в водном растворе подвергающиеся электролитической диссоциации с образованием катионов металла и гидроксид-анионов ОН- Эту теорию обычно проходят в школе на уроках химии, хотя она сильно устарела. Для нас такое определение кислоты и основания не подходит хотя бы потому, что многие органические вещества являются основаниями (имеют щелочные свойства), хотя и не содержат никаких катионов металлов.
Теория Бренстеда
Согласно теории Бренстеда, кислота — это соединение, способное отдавать основанию катионы водорода Н+ (является донором Н+). Основания — это соединения, способные принимать у кислоты катионы водорода Н+ (является акцептором Н+). Таким образом, в этой теории одно и то же вещество в зависимости от взаимодействия может быть и кислотой, и основанием. Например, вода при взаимодействии с протоном
H2O + H+ = H3О+
является основанием, а реагируя с аммиаком
NH3 + H2O = NH4+ + OH-,
является кислотой.
Эта теория также отчасти устарела, но для целей данного учебника её вполне можно принять. Итак,
- кислота — вещество, способное в водных растворах отдавать протоны,
- основание — вещество, способное в водных растворах принимать (присоединять) протоны.
Теория кислот и оснований Льюиса
В теории Льюиса было еще более расширено понятие кислоты и основания. Кислота — это молекула, имеющая вакантные электронные орбитали, вследствие чего она способна принимать электронные пары, например BF3, AlCl3. Основание — это молекула, способная быть донором электронных пар. Например, основания Льюиса — все анионы, аммиак и амины, вода, спирты, галогены. Именно эта теория лежит в основе современных представлений о свойствах веществ и ходе химических реакций.
Водородный показатель (рН) среды показывает концентрацию в ней протонов
[править]Водоро́дный показа́тель', pH (произносится «пэ аш»), — это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность. рН вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр:
В чистой воде при 25 °C молярные концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH-]) одинаковы и составляют 10−7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно [H+] · [OH-] и составляет 10−14 моль²/л² (при 25 °C).
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H+] > [OH-] говорят, что раствор является кислым, а при [OH-] > [H+] — щелочным.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентраций ионов водорода пользуются их десятичным логарифмом, взятым с обратным знаком, который собственно и является водородным показателем — pH.
Итак, рН — показатель концентрации ионов водорода (протонов) в растворе. При рН = 7 среда считается нейтральной. При этом концентрация протонов равна 10−7 моль/л. Если рН < 7, то среда кислая. Например, рН желудочного сока — примерно 1,5-2. При рН = 2 концентрация ионов водорода — 10 −2 моль/л, то есть в 10.000 раз больше, чем при рН = 7. Кислотность кишечного сока — около 8-8,5. При рН = 8 концентрация протонов — 10−8 моль/л. Итак, концентрация ионов водорода в желудке и кишечнике отличается в 100.000 раз.
Водородный показатель pH широко используется для характеристики кислотно-основных свойств различных биологических сред.
Вопрос 1. А какова концентрация протонов при рН 8,5? при рН 8,7? Как её вычислить?
Вопрос 2. Объем клетки бактерии — около 2 мкм³, рН цитоплазмы — 7. Сколько протонов содержится в этой клетке?
Кислотность среды влияет на многие химические и биологические процессы
[править]Кислотность среды имеет важное значение для множества химических процессов. Возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы. Они позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи.
pH среды имеет особое значение для биохимических реакций. Концентрация в растворе ионов водорода часто влияет на свойства и биологическую активность белков и нуклеиновых кислот. Поэтому для нормальной работы организма поддержание постоянных значений рН в клетках и внеклеточных жидкостях (например, в крови) — задача исключительной важности. Цитоплазма, плазма крови и другие жидкости организма обладают буферными свойствами; это помогает поддерживать рН на более постоянном уровне.
Кислотность в разных частях тела человека сильно различается. Самая высокая кислотность в полости желудка; там при выделении желудочного сока рН в норме около 1-1,5.
[33] Буферные системы крови
Химический состав живого: химические элементы
[править]Элементный состав тела человека
| Элемент | Массовая доля.% |
|---|---|
| Кислород | 65 |
| Углерод | 18 |
| Водород | 10 |
| Азот | 3 |
| Кальций | 1.5 |
| Фосфор | 1.2 |
| Калий | 0.2 |
| Сера | 0.2 |
| Хлор | 0.2 |
| Натрий | 0.1 |
| Магний | 0.05 |
| Железо | 3.8г у мужчин, 2.3 г у женщин |
| Кобальт, Медь, Цинк, Иод | < 0.05 каждый |
| Селен, Фтор | < 0.01 каждый |
Chemical makeup of the human body — Химический состав тела человека (англ.)
Химический состав живого: молекулы
[править]

Вода в активных клетках составляет обычно 75-85 % по массе. Воды меньше в клетках жировой ткани (около 40 %), ещё меньше может быть в клетках покоящихся стадий (в семенах растений 5-15 % воды). Как в клетке, так и в целом в биосфере Земли вода выполняет важнейшие функции, связанные с ее уникальными свойствами. Свойства эти, в свою очередь, зависят от строения молекул воды.
Молекула воды состоит из одного атома кислорода и присоединенных к нему двух атомов водорода. Связь между ними — ковалентная полярная. Электронная плотность сильно смещена в сторону кислорода, так как он имеет высокую электроотрицательность. Так как химические связи расположены в молекуле воды под углом, на одном полюсе (к которому ближе атомы водорода) сосредотачивается частичный положительный заряд, на другом (там, где находится атом кислорода) — частичный отрицательный заряд. Таким образом, молекула воды представляет собой электрический диполь.
В воде присутствуют межмолекулярные водородные связи
[править]Между молекулами воды образуются водородные связи, причём каждая молекула воды может образовать такие связи, в первом приближении, с четырьмя «соседними».
В жидкой воде молекулы хаотически движутся, и «соседство» это непостоянное; подробнее о структуре жидкой воды см. [34].

Во льду каждая молекула образует связи ровно с четырьмя соседними. Тем не менее, обычный природный лёд имеет гексагональную кристаллическую решётку, причём молекулы в ней упакованы менее плотно, чем в жидкой воде.
Водородные связи определяют уникальные свойства воды
[править]У воды очень высокие температуры кипения, плавления и парообразования, так как нужно затратить дополнительную энергию на разрыв водородных связей. Только вода в обычных земных условиях находится во всех трех агрегатных состояниях одновременно. Другие вещества со сходным строением и молекулярной массой, такие как H2S, HCl, NH3 при обычных условиях являются газами.
По их отношению к воде все вещества делятся на гидрофильные и гидрофобные
[править]
Все вещества по отношению их к воде в первом приближении делятся на гидрофильные и гидрофобные. Гидрофильные («любящие воду») вещества обычно имеют полярные молекулы (или кристаллические решетки с ионными связями).
Многие гидрофильные вещества хорошо растворяются в воде (а если это жидкости — то смешиваются с ней в любых соотношениях). К гидрофильным веществам можно отнести поваренную соль NaCl, аммиак NH3, спирт C2H5OH.
Но многие гидрофильные вещества нерастворимы. Тогда их поверхность хорошо смачивается водой. К таким веществам относится, например, шерсть (состоящая из белка кератина), бумага (состоящая из целлюлозы) и др.
Гидрофобные («боящиеся воды») вещества плохо растворяются в воде, не смачиваются ею (а если это жидкости — то не смешиваются с ней).
- Вопрос 1
- Почему вещества с полярными молекулами и ионной кристаллической решеткой гидрофильны, а вещества с неполярными молекулами гидрофобны?
- Вопрос 2
- Почему некоторые гидрофильные вещества растворимы в воде, а другие — нет?
Гидрофильность и гидрофобность — частный случай лиофильности и лиофобности. Кроме гидрофильности, можно говорить про липофильность (олеофильность) и др.
Задача 1
Мениск — поверхность воды, налитой, например. в пробирку. Какую форму — вогнутую или выпуклую — будет иметь мениск, если налить воду в пробирку из гидрофильного материала? гидрофобного материала? Объясните, почему.
B: Выпуклый мениск.
Некоторые органические вещества амфифильны
[править]
Амфифильность — свойство молекул, одна часть которых гидрофильна, а другая гидрофобна. К амфифильным веществам относятся фосфолипиды, жирные кислоты и их соли (например, мыло), а также липопротеиды и др.. Белки также обладают амфифильными свойствами, так как обычно в их состав входят аминокислоты с гидрофильными и с гидрофобными радикалами.
За счет амфифильных свойств фосфолипидов при взаимодействии с водой они формируют мицеллы, липосомы и липидные бислои (см. Взаимодействие фосфолипидов с водой)..
Амфифильность белков влияет на образуемые ими третичные и четвертичные структуры молекул, а также позволяет молекулам мембранных белков встраиваться в клеточные мембраны.
Вода — полярный растворитель
[править]Вода хорошо растворяет полярные, или гидрофильные вещества — например, растворимые соли, аминокислоты, сахара. Молекулы воды окружают ионы или молекулы вещества, отделяя тем самым частицы друг от друга. Следовательно, в растворе молекулы (или ионы) смогут двигаться более свободно, а значит, быстрее будут протекать химические реакции. Гидрофобные вещества не будут растворяться в воде, зато молекулы H2O, притягиваясь друг к другу, смогут отделить гидрофобное вещество от самой толщи воды. Например, фосфолипиды, из которых состоит клеточная мембрана, могут благодаря взаимодействию с водой формировать липидный бислой.
Вода выполняет разнообразные функции в клетке и в организме
[править]Вода — полярный растворитель (см.выше)
Вода — реагент
Вода в качестве реагента участвует во многих химических реакциях:
- В ходе фотосинтеза у растений происходит фотолиз воды — водород из состава воды входит в органические вещества, а свободный кислород выделяется в атмосферу.
Уравнение фотосинтеза:
- Вода участвует в гидролизе — разрушении веществ с присоединением воды. Например, гидролиз жиров, белков и углеводов происходит при переваривании пищи, а при гидролизе АТФ выделяется энергия, обеспечивающая нужда клетки.
- При гидролизе солей вода является источником протонов и электронов.
Вода поддерживает форму клеток
Вода практически несжимаема (в жидком состоянии), и поэтому служит гидростатическим скелетом клетки. За счет осмоса вода создает избыточное давление внутри вакуолей растительных клеток. это тургорное давление обеспечивает упругость клеточной стенки и поддержание формы органов (например, листьев).
Вода обеспечивает транспорт веществ у растений и животных
- У растений, благодаря, в частности, капиллярному эффекту, осуществляется всасывание из почвы раствора минеральных солей и их подъем от корня к другим частям растения по сосудам. Транспорт продуктов фотосинтеза происходит посредством перемещения по ситовидным трубкам водного раствора сахарозы.
- Вода обеспечивает транспорт питательных веществ и выведение из организма в растворенном виде продуктов обмена веществ у животных (вода — основной компонент плазмы крови и лимфы), а также играет важную роль в работе выделительной системы.
Вода участвует в терморегуляции
Вследствие своей большой теплоемкости — 4200 Дж/(кг x К) — вода обеспечивает примерное постоянство температуры внутри клетки. Вода может переносить большое количество теплоты, отдавая ее там, где температура тканей ниже, и забирая там, где температура более высокая. Также при испарении воды происходит значительное охлаждение из-за того, что много энергии тратится на разрыв водородных связей при переходе из жидкого состояния в газообразное. Испарение жидкости — единственный способ, который позволяет теплокровным поддерживать постоянную температуру, когда температура окружающей среды становится выше температуры тела.
Полезные книги и статьи по теме:
- [35] М. А. Констаниновский. Почему вода мокрая. (По этой ссылке можно скачать книгу в формате djvu). Простым и понятным языком описываются основные свойства воды.
- [36]Вода знакомая и загадочная. Леонид Кульский, Воля Даль, Людмила Ленчина
(наряду с полезными сведениями книга содержит изложение непроверенных и неподтвержденных гипотез об «активированной» воде!)
- [37]Water Structure and Science (англ.) — достаточно сложная научная книга о воде
- Hydrophobe — Статья о гидрофобности и сверхгидрофобности из англоязычной Википедии
- [38] Анимация "Свойства воды " (англ. текст)
Неорганические вещества. Функции ионов
[править]Калий — один из главных биогенных элементов, необходимых для роста растений. При его недостатке в почве резко падает урожайность, поэтому главное использование калия человеком — производство минеральных удобрений. В организме калий находится в виде катионов в основном в цитоплазме (у животных его концентрация в цитоплазме примерно в 40 раз выше, чем в крови), у растений также в клеточном соке вакуолей.
Кальций — распространенный макроэлемент в организме растений, животных и человека. В организме человека и других позвоночных большая его часть содержится в скелете и зубах в виде фосфатов. Из различных форм карбоната кальция (извести) состоят скелеты большинства групп беспозвоночных (губки, коралловые полипы, моллюски и др.). Ионы кальция участвуют в процессах свёртывания крови, а также в обеспечении постоянного осмотического давления крови. Ионы кальция также служат одним из универсальных вторичных посредников и регулируют самые разные внутриклеточные процессы — мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов и др. Концентрация ионов кальция в цитоплазме клеток человека составляет около 10−7 моль, в межклеточных жидкостях около 10−3 моль.
Фосфор, как и кальций, в организме позвоночных в наибольшем количестве содержится в составе минеральных солей скелетных тканей. Скелет позвоночных состоит в основном из гидроксиапатита (его эмпирическая формула — Ca5(PO4)3(OH))
Внутриклеточная и внеклеточные концентрации некоторых ионов (внутриклеточные концентрации указаны для мышечной клетки теплокровного животного), ммоль/л
| Ион | Внутриклеточная концентрация | Внеклеточная концентрация |
|---|---|---|
| Na+ | 12 | 145 |
| K+ | 155 | 4 |
| Cl- | 4 | 110 |
| HCO3 - | 8 | 27 |
| Ca2+ | 10−4 | 2 |
| Фосфат-ионы | 2 | 2 |
| Анионы органических соединений | 155 | - |
[39] И. С. Кулаев Неорганические полифосфаты и их роль на разных этапах клеточной эволюции. Сросовский образовательный журнал, 1006, N 2, с.28-35
Органические вещества, органические соединения — класс соединений, в состав которых входит углерод (за исключением карбидов, карбонатов, оксидов углерода и цианидов).
Название органические соединения появилось на ранней стадии развития химии во время господства виталистических воззрений. Вещества при этом разделялись на минеральные — принадлежащие царству минералов, и органические — принадлежащие царствам животных и растений. Считалось, что для синтеза органических веществ необходима особая «жизненная сила», присущая только живому, и поэтому синтез органических веществ из неорганических невозможен. Это представление было опровергнуто Фридрихом Вёлером в 1824 году путём синтеза «органической» мочевины из «минерального» цианата аммония, однако деление веществ на органические и неорганические сохранилось в химической терминологии и по сей день.
Количество известных органических соединений давно перевалило за 10 млн. Таким образом, органические соединения — самый обширный класс веществ. Многообразие органических соединений связано с уникальным свойством углерода образовывать цепочки из атомов углерода, что в свою очередь обусловлено высокой стабильностью (то есть энергией) углерод-углеродной связи. Связь углерод-углерод может быть как одинарной, так и кратной — двойной или тройной. При увеличении кратности углерод-углеродной связи возрастает её энергия, то есть стабильность, а длина уменьшается. Высокая валентность углерода — 4, а также возможность образовывать кратные связи позволяет атомам углерода, содединяясь в молекулы, образовывать структуры различной размерности (линейные, плоские, объёмные).
Различная топология образования связей между атомами, образующими органические соединения (прежде всего, атомами углерода), приводит к появлению изомеров — соединений, имеющих один и тот же состав и молекулярную массу, но обладающих разной структурой и потому различными физико-химическими свойствами. Данное явление носит название изомерии.
Большинство органических веществ горючи, а при нагревании обугливаются.
Основные классы органических соединений клеток
[править]Основными классами органических соединений клетки считают белки, нуклеиновые кислоты, липиды и углеводы. На долю этих групп веществ приходится более 25 % массы клетки и наибольшее разнообразие типов молекул. При этом такие малые молекулы, как аминокислоты (и их предшественники), нуклеотиды и их предшественники, а также моносахардиы и их предшественники (часть углеводов) и жирные кислоты и их предшественники (часть липидов), то есть малые молекулы, в сумме составляют не более 3 % массы клетки, хотя они тоже довольно разнообразны (см. таблицу).
Разнообразие органических веществ бактериальной клетки (по Альбертс и др.)
| Вещество или класс веществ | % от массы клетки | Число типов молекул |
|---|---|---|
| Вода | 70 | 1 |
| Неорганические ионы | 1 | 20 |
| Моносахариды и их предшественники | 1 | 250 |
| Аминокислоты и их предшественники | 0,4 | 100 |
| Нуклеотиды и их предшественники | 0,4 | 100 |
| Жирные кислоты и их предшественники | 1 | 250 |
| Другие малые органические молкулы | 0,2 | 300 |
| Макромолекулы (белки, нуклеиновые кислоты, полисахариды) | 26 | 3000 |
Липиды — группа органических соединений, хорошо растворимых в неполярных органических растворителях (бензол, ацетон, хлороформ) и практически нерастворимых в воде.
C точки зрения современной органической химии это определение является неточным. Во-первых, такое определение вместо четкой характеристики класса химических соединений говорит лишь о физических свойствах. Во-вторых, в настоящее время известно достаточное количество соединений, нерастворимых в неполярных растворителях или же, наоборот, хорошо растворимых в воде, которые, тем не менее, относят к липидам. В современной органической химии определение термина «липиды» основано на биосинтетическом родстве данных соединений — к липидам относят жирные кислоты и их производные [40]. В то же время в биохимии и других разделах биологии к липидам по-прежнему принято относить и гидрофобные или амфифильные вещества другой химической природы [41]. Мы будем придерживаться «биохимического» определения.
Жиры, или триглицериды — природные органические соединения, полные сложные эфиры глицерина и одноосновных жирных кислот.
Наряду с углеводами и белками, жиры — один из главных компонентов клеток животных, растений и микроорганизмов.
Жидкие жиры растительного происхождения обычно называют маслами [42].
Состав жиров отвечает общей формуле:
CH2-O-C(O)-R¹ | CH-О-C(O)-R2 | CH2-O-C(O)-R³,
где R¹, R2 и R³ — радикалы (иногда — различных) жирных кислот.
Как правило, в состав масел входят преимущественно ненасыщенные жирные кислоты (имеющие одну или несколько двойных связей между атомами углерода), а в состав твердых жиров — насыщенные. В составе природных жиров и масел преобладают жирные кислоты с 16-18 атомами углерода в цепи.
Функции жиров
- Запасающая
Главная функция жиров в животном (и отчасти — растительном) мире — запасающая. При полном окислении 1 г жира (до углекислого газа и воды) выделяется около 9 ккал энергии. (1 ккал = 1000 кал; калория (кал, cal) — внесистемная единица количества работы и энергии, равная количеству теплоты, необходимому для нагревания 1 мл воды на 1 °C при стандартном атмосферном давлении 101,325 кПа; 1 ккал = 4,19 кДж). При окислении (в организме) 1 г белков или углеводов выделяется только около 4 ккал/г.
- Вопрос 1
- Почему практически все животные используют жир в качестве основного запасного вещества практически во всех клетках и тканях, кроме яйцеклеток, а растения, как правило, запасают крахмал и только в семенах многие из них используют жиры? Подумайте, с чем связаны исключения; это поможет вам ответить на основной вопрос.
При окислении жира выделяется так называемая «метаболическая» вода, так что запасы жира отчасти служат и запасами воды.
- Уменьшение плотности
У самых разных водных организмов — от одноклеточных диатомовых водорослей до гигантских акул — жир служит «поплавком», уменьшая среднюю плотность тела. Плотность животных жиров составляет около 0,91-0,95 г/см³. Плотность костной ткани позвоночных близка к 1,7-1.8 г/см³, а средняя плотность большинства других тканей близка к 1 г/см³. Понятно, что жира нужно довольно много, чтобы «уравновесить» тяжелый скелет.
- Вопрос 2
- Плотность воздуха примерно в 600 раз меньше плотности воды, и некоторые организмы используют воздушные пузыри как поплавки (например, у многих рыб есть плавательный пузырь). В чём состоят возможные преимущества жирового «поплавка» по сравнению с воздушным?
- Теплоизоляция (у теплокровных)
Часто жир служит теплоизоляцией для теплокровных животных. Особенно это важно для таких животных, как киты или тюлени, много времени проводящих в холодной воде. У них подкожный слой жира особенно толстый.
- Вопрос 3
- Почему тюлени имеют более толстый слой подкожного жира, чем, например, волк или белый медведь? Ведь они бывают активны при температуре ниже −30оС, а температура воды, в которой живут тюлени, всегда выше 0оС.
- Вопрос 4
- У некоторых животных жир запасается не под кожей, а в определенных органах (на определенных участках тела). Что это за животные? Как эта особенность связана с их образом жизни?
- Механическая защита
Толстый подкожный слой жира — довольно надежная защита внутренних органов от механических повреждений при ударах.
Фосфолипиды
[править]
Фосфолипиды похожи на нейтральные жиры тем, что в их состав тоже входят остатки глицерина и жирных кислот. Но фосфолипиды отличаются от нейтральных жиров тем, что в состав фосфолипидов входят только два остатка жирной кислоты. Третья эфирная связь образуется между глицерином и остатком фосфорной кислоты (фосфатом), к которому присоединена группа атомов, разная у различных фосфолипидов (радикал), содержащая обычно положительно заряженный атом азота (см.рис.).
Эта часть молекулы фосфолипидов («голова») гидрофильна, а состоящие из жирных кислот «хвосты» гидрофобны. Таким образом, фосфолипиды — типичные амфифильные вещества (см. Взаимодействие фосфолипидов с водой).
Другие группы липидов
[править]Углево́ды — общее название обширного класса природных органических соединений. Название происходит от слов «уголь» и «вода». Причиной этого является то, что первые из известных науке углеводов описывались брутто-формулой Cx(H2O)y, формально являясь соединениями углерода и воды.
В животных клетках углеводы составляют не более 5 % сухой массы, а в некоторых растительных(например, клубни картофеля) их содержание достигает 90 % сухой массы.
По способности к гидролизу на мономеры углеводы делятся на две группы: простые (моносахариды) и сложные (олигосахариды и полисахариды). Сложные углеводы, в отличие от простых, способны гидролизоваться с образованием простых углеводов, мономеров.
Биологическое значение углеводов:
- Углеводы выполняют структурную функцию, то есть участвуют в построении различных клеточных структур (например, клеточных стенок растений.
- Углеводы выполняют защитную роль у растений (клеточные стенки, состоящие из клеточных стенок мертвых клеток защитные образования — шипы, колючки и др.).
- Углеводы выполняют пластическую функцию — хранятся в виде запаса питательных веществ, а также входят в состав сложных молекул (например, пентозы (рибоза и дезоксирибоза) участвуют в построении АТФ, ДНК и РНК.
- Углеводы являются основным энергетическим материалом. При окислении 1 грамма углеводов выделяются 4,1 ккал энергии и 0,4 г воды.
- Углеводы участвуют в обеспечении осмотического давления и осморегуляции. Так, в крови содержится 100—110 мг/% глюкозы. От концентрации глюкозы зависит осмотическое давление крови.
- Углеводы выполняют рецепторную функцию — многие олигосахариды входят в состав воспринимающей части клеточных рецепторов или молекул-лигандов.
В суточном рационе человека и животных преобладают углеводы. Травоядные получают крахмал, клетчатку, сахарозу. Хищники получают гликоген с мясом.
Организмы животных не способны синтезировать углеводы из неорганических веществ. Они получают их от растений с пищей и используют в качестве главного источника энергии, получаемой в процессе окисления.
Моносахариды
[править]Моносахариды хорошо растворяются в воде. Многие из них синтезируются в клетках растений.

Моносахариды рибоза и дезоксирибоза входят в состав нуклеиновых кислот. Глюкоза С6Н12О6 присутствует в клетках всех организмов и является одним из источников энергии для животных. У человека глюкоза переносится кровью и опглощается клетками с помощью нескольких белков-транспортеров. Поглощение глюкозы клетками регулирует гормон инсулин.
Дисахариды
[править]Дисахариды — это общее название подкласса олигосахаридов. Молекула дисахарида состоит из двух молекул моносахаридов, которые соединены гликозидной связью. Дисахариды образуются в результате реакции конденсации между двумя моносахаридами, обычно гексозами. При реакции конденсации происходит удаление воды. После соединения моносахаридных единиц их называют остатками. Наиболее распространенные дисахариды — это лактоза и сахароза. Также к дисахаридам относится мальтоза.
Олигосахариды
[править]
Олигосахариды — это олигомеры, состоящие из нескольких (обычно от 3 до 10, не более 20) мономеров — моносахаридов, связанных между собой гликозидной связью. В отличие от них полисахариды состоят из десятков, сотен или тысяч моносахаридов. Дисахариды иногда считают частным случаем олигосахаридов.
Многие олигосахариды соединены либо с белками (тогда образуются гликопротеины), либо с липидами (образуются гликолипиды).
Олигосахариды часто служат «метками» при внутриклеточном транспорте белков. Эти «метки», опознаваемые белками-рецепторами, позволяют доставить белок внутри мембранного пузырька в нужный компартмент клетки.
Специфические олигосахариды (входящие в состав гликопротеидов) на поверхности эритроцитов определяю группу крови человека.
Многие рецепторы плазмалеммы — это гликопротеиды, в состав которых входят специфичные олигосахариды. Видимо, они участвуют в «опознавании» и связывании сигнальных молекул.
Заякоренные на мембране олигосахариды образуют гликокаликс — слой на наружной поверхности животных клеток. Толщина этого слоя от 15 до 150 нм. В хорошо развитом гликокаликсе на поверхности энтероцитов содержатся пищеварительные ферменты и происходит один их этапов пристеночного пищеварения.
Наиболее распространенные полисахариды — целлюлоза, крахмал и гликоген
[править]Полисахари́ды — общее название класса сложных высокомолекулярных углеводов, молекулы которых состоят из десятков, сотен или тысяч мономеров — моносахаридов. Важнейшие (для человека, а возможно, и для всей биосферы) полисахариды — целлюлоза, крахмал и гликоген.

Целлюлоза — основной компонент клеточных стенок растений и главная пища травоядных животных
[править]Целлюлоза — гомополимер. Её молекула состоит из остатков молекул глюкозы, которая образуется при кислотном гидролизе целлюлозы (под действием сильных кислот при высокой температуре):
Целлюлоза — линейный полимер. Молекулы целлюлозы представляют собой длинные нити, содержащие 300-10.000 остатков глюкозы, без боковых ответвлений. Эти нити соединены между собой множеством водородных связей, что придает целлюлозе большую механическую прочность. Водородные связи соединяют молекулы целлюлозы в волокна — фибриллы.
Целлюлоза нерастворима в воде, но очень гидрофильна.
Целлюлоза — один из главных компонентов клеточных стенок растений.
Считается, что в составе биомассы целлюлозы больше, чем любого другого вещества. В растительной биомассе целлюлозы около трети, в древесине — 50 %, в хлопковой вате — около 90 %.
Её разновидности (или похожие на неё вещества)содержатся в клеточных стенках многих протистов и некоторых бактерий. Покровы асцидий пропитаны похожим на целлюлозу веществом туницином; видимо, это единственный случай синтеза целлюлозы животными.
Целлюлозой питаются многочисленные организмы — бактерии, грибы, протисты и животные. Целлюлоза — главный источник питательных веществ для большинства травоядных животных. У млекопитающих (как и у большинства других животных) нет ферментов, способных расщеплять целлюлозу. Однако многие травоядные животные (например, жвачные) имеют в пищеварительном тракте бактерий-симбионтов, которые расщепляют и помогают хозяевам усваивать этот полисахарид.
Крахмал — основное запасное вещество растений и главная пища для человека
[править]

Крахмал, как и целлюлоза, состоит из остатков глюкозы. Это — смесь двух полисахаридов, амилозы и амилопектина. Обычно в крахмале 20-25 % амилозы и 75-80 % амилопектина.
Амилоза — длинные линейные цепочки остатков глюкозы, соединенных 1,4-связью (связь между первых и четвертым атомами углерода). Как правило, в молекуле амилозы от 300 до 3.000 остатков глюкозы. В воде амилоза хорошо растворяется. Именно амилоза дает синее окрашивание с раствором иода.
Амилопектин представляет собой разветвленные цепочки. В точках ветвления, отстоящих в среднем на 25-30 остатков глюкозы, имеются не только 1,4-, но и 1,6-связи. Молекула амилопектина содержит от 2.000 до 200.000 остатков глюкозы. С раствором иода амилопектин даёт красноватое окрашивание.
Гликоген используется для запасания энергии в клетках животных
[править]Гликоген по строению очень похож на амилопектин. Он отличается только большей разветвленностью молекулы (точки ветвления отстоят в среднем на 8-12 остатков). В клетках животных и грибов гликоген накапливается как запасное питательное вещество, которое легко превратить в глюкозу. У человека гликоген запасается в печени (до 8 % сырой массы) и скелетных мышцах (1-2 % сырой массы).
Нуклеиновые кислоты, их функции
[править]ДНК — носитель наследственной информации
[править]Дезоксирибонуклеи́новая кислота́ (ДНК) — один из двух типов нуклеиновых кислот, обеспечивающих хранение, передачу из поколения в поколение и реализацию генетической информации. Основная роль ДНК в клетках — долговременное хранение и передача из поколения в поколение информации о структуре РНК и белков.
В клетках эукариот ДНК находится в ядре клетки в составе хромосом, а также в некоторых клеточных органоидах (митохондриях и w:пластидах). В клетках прокариот кольцевая (за редкими исключениями) молекула ДНК, так называемый генофор, входит в состав нуклеоида.
У прокариот и у низших эукариот (например, у дрожжей) встречаются также небольшие автономные, преимущественно кольцевые молекулы ДНК, называемые плазмидами. В клетках молекулы ДНК всегда двухцепочечные, то есть состоят из двух цепей нуклеотидов. Кроме того, одно- или двухцепочечные молекулы ДНК могут образовывать геном ДНК-содержащих вирусов.


ДНК — это длинная полимерная молекула, состоящая из повторяющихся блоков, нуклеотидов. Каждый нуклеотид состоит из азотистого основания, сахара (дезоксирибозы) и фосфатной группы (остатка фосфорной кислоты). Связи между нуклеотидами в одной цепи ковалентные, они образуются за счёт дезоксирибозы и фосфатной группы. Говорят, что за счет ковалентных связей образуется «сахарофосфатный остов» молекулы.
В подавляющем большинстве случаев макромолекула ДНК состоит из двух цепей, ориентированных азотистыми основаниями друг к другу; только некоторые вирусы содержат одноцепочечную ДНК.
Размер генома широко варьирует среди различных организмов
ДНК — это длинная полимерная молекула, состоящая из четырех типов мономеров, нуклеотидов[43].
Но что значит «длинная»? Длина ДНК из митохондрий человека — около 16.000 п.н. (пар нуклеотидов). Характерный размер ДНК вируса — около 100.000 п.н., бактерий — от 500.000 до 5.000.000 п.н. (это — размер одной молекулы ДНК). В геноме человека около 3.000.000.000 п.н., распределенных по 23 хромосомам. Это значит, что средняя длина молекулы ДНК из ядра человеческой клетки — более 100.000.000 п.н.!
Длина всех молекул ДНК двойного набора хромосом в одной клетке человека равна примерно 2 м. Тело взрослого человека состоит примерно из 5·101313 — 10·1013 клеток. Расчеты показывают, что общая длина молекул ДНК всех клеток одного человека около 1011 км, что примерно в тысячу раз больше расстояния от Земли до Солнца.
Образование связей между основаниями
Между азотистыми основаниями двух разных цепей образуются водородные связи, которые удерживают вместе две цепи. Эта двухцепочечная молекула спирализована. В целом структура молекулы ДНК получила название «двойной спирали».

В ДНК встречается четыре вида азотистых оснований: аденин, гуанин, тимин и цитозин. Азотистые основания одной из цепей соединены с азотистыми основаниями другой цепи водородными связями согласно принципу комплементарности: аденин соединяется только с тимином, гуанин — только с цитозином.
Биологический закон, в соответствии с которым установлены количественные соотношения между азотистыми основаниями разных типов, назван правилом Чаргаффа в честь ученого биохимика Эрвина Чаргаффа, под руководством которого были обнаружены закономерности в соотношении нуклеотидов. Для того, чтобы определить точные количественные соотношения нуклеотидов, Чаргафф разделил нуклеотиды ДНК методом бумажной хроматографии. Ему удалось выявить три закономерности:
- Число аденинов равно числу тиминов, а число гуанинов — числу цитозинов: А=Т, Г=Ц
- Число пуринов равно числу пиримидинов: А+Г=Т+Ц
- Число аденина и цитозина равно числу гуанина и тимина: А+Ц=Г+Т
Соотношение комплементарных нуклеотидов может быть различным у разных ДНК. В одних ДНК могут преобладать пары аденин-тимин, а в других — гуанин-цитозин. На основе правила Чаргаффа можно сделать вывод, что состав нуклеотидов в разных ДНК отличается лишь суммарным числом комплементарных оснований.

Каждое основание на одной из цепей связывается с одним определённым основанием на второй цепи. Такое специфическое связывание называется комплементарным. Пурины (основания, которые состоят из двух колец и имеют более крупные размеры — аденин и гуанин) комплементарны пиримидинам (тимину и цитозину, которые состоят из одного кольца и меньше по размерам): аденин образует связи только с тимином, а цитозин — с гуанином. Благодаря этому каждая пара оснований имеет «стандартные» размеры, а вся спираль ДНК сохраняет одинаковый диаметр и регулярную структуру.
В двойной спирали цепочки также связаны с помощью гидрофобных связей и стэкинга, которые не зависят от последовательности оснований ДНК.
Последовательность нуклеотидов позволяет «кодировать» информацию и составляет генетический код. Прежде всего в ДНК закодирована информация о различных типах РНК. Для реализации наследственной информации наиболее важны информационные, или матричные РНК (мРНК), рибосомальные РНК (рРНК) и транспортные РНК (тРНК). На информационную РНК «переписывается» содержащаяся в ДНК информация о последовательности аминокислот в белках.
Все эти типы РНК синтезируются на матрице ДНК за счёт копирования последовательности ДНК в последовательность РНК, синтезируемой в процессе транскрипции, и принимают участие в биосинтезе белков (процессе трансляции).
В одной цепи ДНК последовательность нуклеотидов (порядок их чередования) может быть любым. Поэтому молекулы ДНК практически бесконечно разнообразны. Разные виды живых организмов и разные особи одного вида различаются, в частности, порядком расположения нуклеотидов в ДНК. Комплементарность двойной спирали означает, что информация, содержащаяся в одной цепи, содержится и в другой цепи (порядок нуклеотидов одной цепи однозначно задает порядок расположения нуклеотидов в противоположной, комплементарной цепи). Такое «дублирование» информации очень важно для удвоения ДНК, репарации (исправления повреждений в ДНК) и всех остальных функций ДНК в живых организмах.
Помимо кодирующих последовательностей, ДНК клеток содержит последовательности, выполняющие регуляторные и структурные функции. Кроме того, в геноме эукариот часто встречаются участки, принадлежащие «генетическим паразитам», например, транспозонам.
Так как водородные связи слабые, они легко разрываются и восстанавливаются. Цепочки двойной спирали могут расходиться как замок-молния под действием ферментов — хеликаз. Разрыв водородных связей необходим для процессов удвоения ДНК.
Разные пары оснований образуют разное количество водородных связей. Аденин и тимин связаны двумя, а гуанин и цитозин — тремя водородными связями, поэтому на разрыв ГЦ-пары требуется больше энергии, чем на разрыв АТ-пары.
Две цепи одной спирали ДНК также расходятся (диссоциируют) при высокой температуре. Процент ГЦ-пар и длина молекулы ДНК определяют количество энергии, необходимой для разделения цепей: длинные молекулы ДНК с большим содержанием ГЦ более тугоплавки.
Части молекул ДНК, которые из-за их функций должны быть легко разделяемы, например ТАТА последовательность в бактериальных промоторах, обычно содержат большое количество А и Т.
Расшифровка структуры ДНК (1953 г.) стала одним из поворотных моментов в истории биологии. За выдающийся вклад в это открытие Фрэнсису Крику, Джеймсу Уотсону, Морису Уилкинсу была присуждена Нобелевская премия по физиологии и медицине 1962 г.
Рибонуклеи́новые кисло́ты (РНК) — нуклеиновые кислоты, полимеры нуклеотидов, в состав которых входят остаток ортофосфорной кислоты, рибоза (в отличие от ДНК, содержащей дезоксирибозу) и азотистые основания — аденин, цитозин, гуанин и урацил (в отличие от ДНК, содержащей вместо урацила тимин). Эти молекулы содержатся в клетках всех живых организмов, а также в некоторых вирусах.
В клетках эукариот, как выяснилось за последние десятилетия, есть множество разных типов молекул РНК, многие из которых никогда не покидают ядра (мяРНК, малые ядерные РНК). Функции многих из них не известны. Другие малые РНК (например, siРНК) участвуют в процессе РНК-интерференции.
Главную роль в процессе синтеза белка играют три типа РНК:
- информационная РНК, или иРНК (сейчас её всё чаще называют мРНК — от англ. messenger RNA, хотя по-русски «м» чаще расшифровывают как «матричная»);
- транспортная РНК, или тРНК;
- рибосомальная РНК, или рРНК.
Все эти молекулы РНК, как и другие типы РНК, синтезируются на матрице ДНК и закодированы в специальных генах. Гены, которые кодируют иРНК, кодируют также и белки, поскольку иРНК содержит информацию о последовательности аминокислот в одном или нескольких белках. Гены, которые кодируют другие типы РНК, не кодируют белков. Поэтому с современных позиций правильнее определять ген как участок ДНК, кодирующий одну молекулу РНК (а не белок).
Белки, их функции
[править]-Без белка жить можно,- сказал я,- а вот как он живет без потрохов?
-А вот товарищ Амперян говорит, что без белка жить нельзя,- сказал Витька, заставляя струю табачного дыма сворачиваться в смерч и ходить по комнате, огибая предметы.
-Я говорю, что жизнь- это белок,- возразил Эдик.
-Не ощущаю разницы,- сказал Витька.- Ты говоришь, что если нет белка, то нет и жизни.
А. и Б. Стругацкие «Понедельник начинается в субботу»
Мономеры белков — аминокислоты. Разнообразие и химические свойства аминокислот
[править]
Для синтеза белков используются двадцать стандартных аминокислот: именно они закодированы в ДНК триплетами генетического кода. Примечательно, что живые организмы используют в основном L-аминокислоты.
У некоторых организмов триплеты могут кодировать и «неканонические», нестандартные аминокислоты (например, селеноцистеин). Некоторые аминокислоты могут (обычно при участии ферментов) химически модифицироваться после синтеза белков, так что в составе «зрелых» белков обнаруживается более 20 разновидностей аминокислот.
Аминокислоты обычно присутствуют в растворах в виде цвиттер-ионов и являются амфолитами. Амфолитами называют молекулы, в структуре которых присутствуют как кислотные, так и основные группы, существующие в виде цвиттер-ионов при определённых значениях pH. Этот pH обозначается как изоэлектрическая точка молекулы.
Амфолиты образуют буферные растворы. Благодаря способности к выборочной ионизации они противодействуют изменению pH при добавлении кислоты или основания. В присутствии кислот они принимают на себя протоны, удаляя последние из раствора, и противодействуют повышению его кислотности. При добавлении оснований амфолиты высвобождают ионы водорода в раствор, препятствуя возрастанию pH, и тем сохраняя его равновесие.
[44] Физическиe и химичeскиe cвойства аминокислот
Функции аминокислот разнообразны
[править]Аминокислоты играют важнейшую роль в обмене веществ.
Кроме того, что аминокислоты служат мономерами для синтеза белков, они входят в состав некоторых небелковых веществ — муреина, некоторых антибиотиков и др. Глицин и глутаминовая кислота — важные нейромедиаторы.
Выделяют несколько уровней укладки белковых молекул
[править]Выделяют четыре основных уровня укладки белковых молекул (уровни структуры белка):
- Первичная структура — последовательность аминокислот в полипептидной цепи.
- Вторичная структура — локальное упорядочивание фрагментов полипептидной цепи, стабилизированное водородными связями и гидрофобными взаимодействиями.
- Третичная структура — пространственное строение полипептидной цепи; взаимное расположение элементов вторичной структуры, стабилизированное различными типами связей.
- Четверичная структура — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.

Первичная структура белка — последовательность аминокислот, соединенных пептидными связями
[править]
Молекулы белков представляют собой полимеры, состоящие из мономеров — α-L-аминокислот и, в некоторых случаях, из модифицированных аминокислот. По своей структуре белки — линейные нерегулярные гетерополимеры. Это означает, что полипептидные цепочки из аминокислот обычно не ветвятся и не образуют колец, в их состав входят разные мономеры, и они могут чередоваться в различной последовательности.
При образовании белка в результате взаимодействия α-аминогруппы (-NH2) одной аминокислоты с α-карбоксильной группой (-СООН) другой аминокислоты образуются пептидные связи. Концы белка называют С- и N-концом (в зависимости от того, какая из групп концевой аминокислоты свободна: -COOH или -NH2, соответственно). При синтезе белка на рибосоме новые аминокислоты присоединяются к C-концу, поэтому название пептида или белка даётся путём перечисления аминокислотных остатков начиная с N-конца.
Для обозначения аминокислот в научной литературе используются одно- или трёхбуквенные сокращения. На первый взгляд может показаться, что использование в большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие белков. На самом деле количество вариантов трудно переоценить: для цепочки всего из 5 аминокислот оно составляет уже более 3 миллионов, а цепочка из 100 аминокислот (небольшой белок) может быть представлена более чем в 10130 вариантах. Однако большинство вариантов не реализуются в природе, так как такие белки не смогли бы выполнять никаких функций.
Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, а более длинные — белками, хотя это деление весьма условно.
Вторичная структура белка — α-спирали и β-слои
[править]- Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями и гидрофильно-гидрофобными взаимодействиями. Две наиболее распространенные вторичные структуры -
α-спирали иβ-листы (складчатые слои).
- α-спирали — плотные витки вокруг длинной оси молекулы. Один виток составляют 3,6 аминокислотных остатка, спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученные спирали.
Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина; близко расположенные остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остаток пролина вызывает изгиб цепи и также нарушает α-спирали.
- β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры R-групп аминокислот, преобладают обычно глицин и аланин.
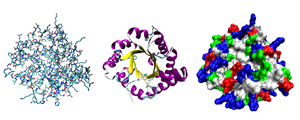
Образование третичной структуры. Глобулярные и фибриллярные белки. Связи, участвующие в формировании третичной структуры
[править]Кроме последовательности аминокислот полипептида (первичной структуры), крайне важна трёхмерная структура белка, которая формируется в процессе фолдинга (от англ. folding), «сворачивание»). Трёхмерная структура формируется в результате взаимодействия структур более низких уровней.
- Третичная структура — пространственное строение полипептидной цепи; взаимное расположение элементов вторичной структуры, стабилизированное различными типами взаимодействий. В стабилизации третичной структуры принимают участие:
- ковалентные связи между двумя отсатками цистеина — дисульфидные мостики;
- ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
- водородные связи;
- гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Белки разделяют на две основные группы с разной трёхмерной структурой. Большинство белков — глобулярные: общая форма из молекулы более или менее сферическая. Меньшая часть белков фибриллярные: их молекулы (обычно и надмолекулярные комплексы) в работающем состоянии — вытянутые волокна. К фибриллярным белкам относятся, например, кератин и коллаген.
Среди глобулярных и фибриллярных белков выделяют подгруппы. Например, изображённый на картинке справа глобулярный белок триозофосфатизомераза состоит из восьми α-спиралей, расположенных на внешней поверхности структуры, и восьми параллельных β-слоёв внутри структуры. Белки с подобным трёхмерным строением называются αβ-баррелы (от англ. barrel — бочка).
Четвертичная структура
[править]- Четверичная структура — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру (можно считать её и молекулой, если между разными полипептидными цепями, как это нередко бывает, образуются дисульфидные мостики). В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной.
Надмолекулярные белковые комплексы могут состоять из десятков молекул, многие из них сравнимы по размеру с рибосомами и в последние годы часто описываются как органоиды (см., напр., протеасома). Нередко в их состав входят молекулы РНК (см., напр., сплайсосома).
Постулат Полинга и принцип самосборки. Нарушения постулата Полинга
[править]Суть постулата Полинга заключается в том, что первичная структура белка (последовательность аминокислот) определяет вторичную, третичную и, наконец, четвертичную. Это означает, что все структуры белка, кроме первичной, детерминированы и полностью зависят от начальной последовательности аминокислот. Однако у этого принципа есть исключение — это белки прионы. Прион может существовать в двух конформациях — первая— PrPC, которую он имеет в нормальных клетках (в ней преобладают α-спирали) и «патологическая» — PrPSc (имеет β складчатую структуру). Белок PrPSc при попадании в здоровую клетку катализирует переход клеточного PrPC в патологическую конформацию, что в конечном итоге приводит к гибели клетки.
Белки как молекулярные машины
[править]Основные функции белков в клетке
[править]Запасающая (энергетическая) функция
[править]Белки редко используются как специальные запасные вещества. Вероятно, отчасти это связано с высокими энергозатратами, которые требуются для синтеза белка из аминокислот, а частично — с тем, что при «сжигании» белков в ходе катаболизма выделяются ядовитые «осколки» — аммиак, который в организме человека обезвреживается за счет превращения в менее токсичную мочевину.
Тем не менее, в яйцеклетках животных в состав желточных гранул входят белки в качестве запасных веществ (белок яйца — это белок, и желток — тоже белок!). Белки в значительных количествах запасаются в семенах семенных растений; особенно высокий процент их содержится в семенах бобовых. Питательную (энергетическую) функцию выполняют белки молока (казеин и др.).
Так как белки не полностью окисляются в ходе обмена веществ, при их использовании в организме выделяется всего около 4-4,1 ккал/г, а при полном окислении — сжигании в калориметре — около 5,6 ккал/г.
Структурная функция
[править]Структурная функция белков заключается в том, что белки
- участвуют в образовании практически всех органоидов клеток, во многом определяя их структуру (форму);
- образуют цитоскелет, придающий форму клеткам и многим органоидам и обеспечивающий механическую форму ряда тканей;
- входят в состав межклеточного вещества, во многом определяющего структуру тканей и форму тела животных.
Белки межклеточного вещества

В теле человека белков межклеточного вещества больше, чем всех остальных белков. Основными структурными белками межклеточного вещества являются фибриллярные белки.
Коллагены — семейство белков, входящих в состав межклеточного вещества. В теле человека составляют до 25 — 30 % общей массы всех белков. Кроме структурной функции коллаген выполняет также механическую, защитную, питательную и репаративную функции. Молекула коллагена представляет собой правозакрученную спираль из трёх α-цепей. Всего у человека имеется 28 типов коллагена. Все они сходны по структуре.
Эластин широко распространён в соединительной ткани, особенно в коже, легких и кровеносных сосудах. Общими характеристиками для эластина и коллагена являются большое содержание глицина и пролина. В эластине значительно больше валина и аланина и меньше глутаминовой кислоты и аргинина, чем в коллагене. В эластине содержатся десмозин и изодесмозин. Эти соединения можно обнаружить только в эластине. Эластин нерастворим в водных растворах (как и коллаген), в растворах солей, кислот и щелочей даже при нагревании. В эластине большое количество аминокислотных остатков с неполярными боковыми группами, что, по-видимому, обусловливает высокую эластичность его волокон.
Другие белки внеклеточного матрикса — ламинины, фибронектин и др. — выполняют как структурную, так и сигнальную функции. Взаимодействуя с мембранными рецепторами, они влияют на миграции клеток и другие стороны их поведения.
Белки цитоскелета Один из основных структурных белков — кератин. В основном из кератина состоят мертвые клетки ороговевающего эпителия и их производные (волосы млекопитющих, рога, копыта, когти, перья птиц, чешуя рептилий и др.). В живых клетках эпителиальных тканей кератины образуют промежуточные филаменты.
Кератины разделяются на две группы: α-кератины и β-кератины. Прочность кератина уступает, пожалуй, только хитину. Характерной особенностью кератинов является их полная нерастворимость в воде при pH 7,0. Содержат в молекуле остатки всех аминокислот. Отличаются от других фибриллярных структурных белков (например, коллагена) в первую очередь повышенным содержанием остатков цистеина. Первичная структура полипептидных цепей a-кератинов не имеет периодичности.
В других типах тканей (кроме эпителиев) промежуточные филаменты образованы похожими на кератин по структуре белками — виментином, белками нейрофиламентов и др. Белки ламины в большинстве клеток жукариот образуют внутреннюю выстилку оболочки ядра. Состоящая из них ядерная ламина поддерживает ядерную мембрану и контактирует с хроматином и ядерными РНК.
Тубулин относится к филаментозным белкам. Димеры тубулина после полимеризации превращаются в нити (протофиламенты). Из них собираются микротрубочки, образующие цитоскелет, который помогает клетке поддерживать форму, обеспечивает связь между органеллами и выполняет ряд других функций.
Актин — тоже филаментозный белок. Из его мономеров при полимеризации образуются тонкие филаменты мышц и микрофиламенты немышечных клеток.
Хотя миозин обычно относят к моторным белкам, в мышечных клетках он входит в состав постоянных структур. В скелетных и сердечной мышцах миозин входит в состав саркомеров, образуя толстые филаменты.
К структурным относятся и многие вспомогательные белки, входящие в состав цитоскелета. Так, в образовании саркомеров участвуют белки титин, тропомиозин и др.
Структурные белки органелл
Белки создают и определяют форму (структуру) многих клеточных органелл. В основном из белков состоят такие органеллы, как рибосомы, протеасомы, ядерные поры и др. Гистоны необходимы для сборки и упаковки нитей ДНК в хромосомы. Из белков состоят клеточные стенки некоторых протистов (например,хламидомонады); в составе оболочки клеток многих бактерий и архей присутствует белковый слой (S-слой), который крепится у грамположительных видов к клеточной стенке, а у грамотрицательных — к наружной мембране. Из белка флагеллина состоят прокариотические жгутики.
Транспортная функция
[править]Транспортная функция белков — участие белков в переносе веществ в клетки и из клеток, в их перемещениях внутри клеток, а также в их транспорте кровью и другими жидкостями по организму.
Есть разные виды транспорта, которые осуществляются при помощи белков.
Перенос веществ через клеточную мембрану
У всех клеток есть мембрана, состоящая из двойного слоя липидов. В клетку должны поступать многие необходимые для жизни вещества (сахара, аминокислоты, ионы щелочных металлов), но мембрана для них непроницаема. Поэтому в состав мембраны входят транспортные белки, которые и осуществляют перенос всех необходимых соединений. Транспорт этих соединений осуществляют две группы белков:
1) белки-переносчики связываются с молекулой или ионом переносимого вещества и каким-либо способом доставляют её внутрь клетки.
2) каналообразующие белки образуют в мембране водные поры, через которые (когда они открыты) могут проходить вещества.
Каналообразующие белки коннексины и паннексины формируют щелевые контакты, через которые низкомолекулярные вещества могут транспортироваться из одной клетки в другую (через паннексины вещества могут проходить и в клетки из внешней среды).
Перенос веществ внутри клетки
Между ядром, другими органоидами и цитоплазмой клетки постоянно идет обмен разными веществами. Например, перенос белков между ядром и цитоплазмой (ядерно-цитоплазматический транспорт)происходит благодаря ядерным порам, которые пронизывают двухслойную оболочку ядра. Они состоят примерно из тридцати белков — нуклеопоринов. Вещества переносятся из цитоплазмы в ядро клетки вместе с беклами — транспортинами. Эти белки узнают вещества, предназначенные для транспорта в ядро, и связываются с ними. Затем этот комплекс белков заякоривается на белках ядерной поры и попадает в её канал, а затем в ядро. Там она связывается ещё с одним белком и распадается, а транспортины направляются обратно в цитоплазму.
Также для транспортировки веществ внутри клеток используются микротрубочки. По их поверхности могут передвигаться митохондрии и мембранные пузырьки. Этот транспорт осуществляют моторные белки. Они делятся на два типа: цитоплазматические динеины и кинезины. Эти две группы белков различаются тем, от какого конца микротрубочки они перемещают груз: динеины от + конца к — концу, а кинезины наоборот.
Перенос веществ по организму
Наиболее известный транспортный белок, транспортирующий вещества по организму — это гемоглобин. Он переносит кислород по кровеносной системе от лёгких к органам и тканям. Также 15 % углекислого газа транспортируется к лёгким с помощью гемоглобина. В скелетных и сердечной мышцах перенос кислорода выполняется белком миоглобином. Жирные кислоты транспортируются альбуминами сыворотки крови. Кроме того, белки группы альбуминов, например, транстиретин, транспортируют гормоны щитовидной железы. Также важнейшей транспортной функцией альбуминов является перенос билирубина, желчных кислот, стероидных гормонов, лекарств и неорганических ионов.
Другие белки крови — глобулины переносят различные гормоны, липиды и витамины. Транспорт ионов меди в организме осуществляет глобулин — церулоплазмин, а транспорт ионов железа — белок трансферрин.
Защитная функция
[править]Защитная функция белков — способность белков обеспечивать защиту организмов от неблагоприятного воздействия различных факторов. Эту функцию белки могут выполнять несколькими различными способами.
Механическая защита
Белки могут обеспечивать механическую защиту клетки или всего организма. Из белков состоит клеточная стенка некоторых протистов (например. одноклеточной водоросли хламидомонады), кутикула нематод и другие покровные образования. У наземных позвоночных ороговение покровного эпителия кожи обеспечивает белок кератин, синтезируемый в клетках эпидермиса. К роговых производных кожи относятся, роговые чешуи рептилий, перья и чехол клюва птиц, шерсть, копыта и рога млекопитающих и др. Состоящие из белков покровные образования могут обеспечивать не только механическую защиту, но и термоизоляцию, защиту от воздействия ультрафиолетового излучения и химических веществ, от потерь жидкости и проникновения в организм бактерий и других паразитов.
Свертывание крови
К механическим защитным функциям белков можно отнести способность крови свертываться, что обеспечивается благодаря белку фибриноген, содержащийся в плазме крови. Когда кровь начинает свертываться, фибриноген расщепляется ферментом тромбином; после расщепления образуется мономер — фибрин, который, в свою очередь, полимеризуется и образует длинные белые нити. Из нитей фибрина и эритроцитов образуется тромб, который при последующей сокращении фибрина затвердевает. Таким образом, фибрин играет главную роль в процессе свертывания крови и предотвращении кровопотери.
Химическая защита
Связывание токсинов белковыми молекулами и действие на токсины ферментов может обеспечивать их обезвреживание. Особенно важную роль в детоксикации у человека играют ферменты печени, расщепляющие яды или переводящие их в растворимую форму, что способствует их быстрому выведению из организма.
В защите клеток от вредных веществ могут принимать участие также транспортные белки, например, многие белки суперсемейства АВС-транспортеров. Эти белки, имеющиеся у всех живых организмов, транспортируют через клеточную мембрану различные вещества (липиды, многие ксенобиотики и др.). АВС-транспортеры обеспечивают защиту бактерий от действия многих антибиотиков, отвечают за явление множественной лекарственной устойчивости| раковых клеток.
Иммунная защита
Иммуная функция белков играет очень важную роль в организме животных. В тот момент, когда в организм попадают возбудители — вирусы или бактерии, в специализированных органах начинают вырабатываться специальные белки — антитела, которые связывают и обезвреживают возбудителей. Особенность иммунной системы заключается в том, что за счет антител она может бороться с почти любыми видами возбудителей.
В иммунной системе играют важную роль не только белки-антитела, но и лизоцимы и белки системы комплемента. Лизоцимы — белки-ферменты, которые разрушают стенки бактерий путем гидролизу их компонентов. Белки комплемента запускают каскад реакций, в результате которых образуется белок МАК (мембраноатакующий комплекс). МАК атакует бактерию, разрушая ее клеточную мембрану. Если этого не произошло, другие белки системы комплемента помечают эту клетку для последующего её уничтожения фагоцитами.
К защитным белкам иммунной системы относятся также интерфероны. Эти белки производят клетки, зараженные вирусами. Их воздействие на соседине клетки обеспечивает противовирусную устойчивость, блокируя в клетках-мишенях размножение вирусов или сборку вирусных частиц. Интерфероны обладают и иными механизмами действия, например, влияют на активность лимфоцитов и других клеток иммунной системы.
Защитная функция токсинов
Белки обеспечивают активную и пассивную ядовитость многих организмов, которая служит для защитыу от врагов или для нападения на добычу. Белки — основной компонент ядов большинства животных, а также некоторых грибов и бактерий. Попадая в организм жертвы, ядовитые белки (токсины) действуют на определенные молекулы или клетки-мишени. Мишенями для большинства токсинов служат клетки нервной системы.
Белки и пептиды содержатся в ядах большинства животных (например, змей, скорпионов, стрекающих и др.). Содержащиеся в ядах белки имеют различные механизмы действия. Так, яды гадюковых змей часто содержат фермент фосфолипазу, который вызывает разрушение клеточных мембран и, как следствие, гемолиз эритроцитов и геморрагию. В яде аспидов преобладают нейротоксины; например, в яде крайтов содержатся белки α-бунгаротоксин (блокатор никотиновых рецепторов ацетилхолина и β-бунгаротоксин(вызывает постоянное выделение ацетилхолина из нервных окончаний и тем самым истощение его запасов); совместное действие этих ядов вызывает смерть от паралича мышц.
Бактериальные белковые яды — ботулотоксин, токсин тетаноспазмин, вырабатываемый возбудителями столбняка, дифтерийный токсин возбудителя дифтерии, холерный токсин. Многие из них являются смесью нескольких белков с разных механизмом действия. Некоторые бактериальные токсины белковой природы являются очень сильными ядами; компоненты ботулотоксина — наиболее ядовитое из известных природных веществ.
Токсины патогенных бактерий рода Clostridium, видимо, требуются анаэробным бактериям для воздействия на весь организм в целом, чтобы привести его к смерти — это дает бактериям «безнаказанно» питаться и размножаться, а уже сильно увеличив свою популяцию покидать организм в виде спор.
Биологическое значение токсинов многих других бактерий точно не известно.
У растений в качестве ядов обычно используются вещества небелковой природы (алкалоиды, гликозиды и др.). Однако у растений встречаются и белковые токсины. Так, в семенах растения семейства молочайные клещевине содержится белковых токсин рицин. Этот токсин проинкает в цитоплазму клеток кишечника, и его ферментативная субъединица, воздействуя на рибосомы, необратимо блокирует трансляцию.
- [45] — Антитела
- [46] — Гемостаз (система свертывания крови)
- [47] — Интерфероны
- [48] — Бактериальные белковые токсины
- [49] — Механизм действия ботулотоксина (англ.)
- [[50]] — Яды животных
Двигательная функция
[править]Двигательные, или моторные белки способны использовать энергию гидролиза АТФ или энергию ионного градиента для совершения механической работы. К моторным белкам относятся, например, миозины, динеины и кинезины. Все эти белки относятся к АТФ-азам, так что они обладают и ферментативной функцией. Однако в изолированном виде они расщепляют лишь одну молекулу АТФ (на одну молекулу белка); образующаяся молекула АДФ остается связанной с белком и препятствует его работе. Расщеплять АТФ постоянно (циклически) они способны при взаимодействии с другими белками. Миозин расщепляет АТФ при взаимодействии с актином в составе микрофиламентов, а динеин и кинезин - при взаимодействии с тубулином в составе микротрубочек.
Рецепторная функция
[править]Многие белки выполняют функцию рецепторов. Слово «рецептор» в биологии употребляется в двух значениях. Рецепторами называются клетки, специализирующиеся на восприятии раздражителей. Это могут быть чувствительные нейроны или другие (не нервные) клетки (например, мышечные веретена).
Рецепторами также называются белки, молекулы которых служат для восприятия сигналов, получаемых клеткой, и запускают ответную реакцию клетки на тот или иной сигнал.
Белок-рецептор — молекула (обычно белок или гликопротеид)? распложеннная на поверхности клетки, клеточных органелл или растворенная в цитоплазме, специфически реагирующая изменением своей формы на присоединение к ней молекулы определенного химического вещества, передающего внешний регуляторный сигнал и, в свою очередь, передающая этот сигнал внутрь клетки или клеточной органеллы, нередко при помощи так называемых вторичных посредников или трансмембранных ионных токов.
Вещество, специфически соединяющееся с рецептором, называется лигандом этого рецептора. Внутри организма это обычно гормон или нейромедиатор либо их искусственные заменители, применяемые в качестве лекарственных средств и ядов (агонисты). Некоторые лиганды, напротив, блокируют рецепторы (антагонисты). Когда речь идет об органах чувств, лигандами являются вещества, воздействующие на рецепторы обоняния или вкуса. Кроме того зрительные рецепторы реагируют на свет, а в органах слуха и осязания рецепторы чувствительны к механическому давлению, вызываемому колебаниями воздуха и иными воздействиями.
Мембранные рецепторы
Очень часто у белков есть гидрофобные участки, которые взаимодействуют с липидами, и гидрофильные участки, которые находятся на поверхности мембраны клетки, соприкасаясь с водным содержимым клетки. Большинство мембранных рецепторов — именно такие трансмембранные белки.
Многие из мембранных белков-рецепторов связаны с углеводными цепями, то есть представляют собой гликопротеиды. На их внеклеточных поверхностях находятся олигосахаридные цепи (гликозильные группы), похожие на антенны. Такие цепочки, состоящие из нескольких моносахаридных остатков, имеют самые различные формы, что объясняется разнообразием связей между моносахаридными остатками и существованием α- и β-изомеров.
Функция «антенн» — это распознавание внешних сигналов. Распознающие участки двух соседних клеток могут обеспечивать сцепление клеток, связываясь друг с другом. Благодаря этому клетки ориентируются и создают ткани в процессе дифференцировки. Распознающие участки присутствуют и в некоторых молекулах, которые находятся в растворе, благодаря чему они избирательно поглощаются клетками, имеющими комплементарные распознающие участки (так, например, поглощаются ЛПНП с помощью рецепторов ЛПНП).
Два основных класса мембранных рецепторов — это метаботропные рецепторы и ионотропные рецепторы.
Ионотропные рецепторы представляют собой мембранные каналы, открываемые или закрываемые при связывании с лигандом. Возникающие при этом ионные токи вызывают изменения трансмембранной разности потенциалов и, вследствие этого, возбудимости клетки, а также меняют внутриклеточные концентрации ионов, что может вторично приводитъ к активации систем внутриклеточных посредников. Одним из наиболее полно изученных ионотропных рецепторов является н-холинорецептор.

Метаботропные рецепторы связаны с системами внутриклеточных посредников. Изменения их конформации при связывании с лигандом приводит к запуску каскада биохимических реакций, и, в конечном счете, изменению функционального состояния клетки. Основные типы мембранных рецепторов:
- Рецепторы, связанные с гетеротримерными G-белками (например, рецептор вазопрессина).
- Рецепторы, обладающие тирозинкиназной активностью (например, рецептор инсулина или рецептор эпидермального фактора роста).
Рецепторы, связанные с G-белками, представляют собой трансмембранные белки, имеющие 7 трансмембранных доменов, внеклеточный N-конец и внутриклеточный C-конец. Сайт связывания с лигандом находится на внеклеточных петлях, домен связывания с G-белком — вблизи C-конца в цитоплазме.
Активация рецептора приводит к тому, что его α-субъединица диссоциирует от βγ-субъединичного комплекса и таким образом активируется. После этого она либо активирует, либо, наоборот инактивирует фермент, продуцирующий вторичные посредники.
Рецепторы с тирозинкиназной активностью фосфорилируют последующие внутриклеточные белки, часто тоже являющиеся протеинкиназами, и таким образом передают сигнал внутрь клетки. По структуре это — трансмембранные белки с одним мембранным доменом. Как правило, в активированном состоянии они образуют гомодимеры, субъединицы которых связаны дисульфидными мостиками.
Внутриклеточные рецепторы
Внутриклеточные рецепторы — как правило, факторы транскрипции (например, рецепторы w:глюкокортикоидов) или белки, взаимодействующие с факторами транскрипции. Большинство внутриклеточных рецепторов связываются с лигандами в цитоплазме, переходят в активное состояние, транспортируются вместе с лигандом в ядро клетки, там связываются с ДНК и либо индуцируют, либо подавляют экспрессию некоторого гена или группы генов.
Особым механизмом действия обладает оксид азота (NO). Проникая через мембрану, этот гормон связывается с растворимой (цитозольной) гуанилатциклазой, которая одновременно является и рецептором оксида азота, и ферментом, который синтезирует вторичный посредник — цГМФ.
Сигнальная функция
[править]Сигнальная функция белков — способность белков служить сигнальными веществами, передавая сигналы между тканями, клетками или организмами.
Сигнальную функцию выполняют белки-гормоны. Связывание гормона с рецептором является сигналом, запускающим в клетке физиологические процессы. Гормоны регулируют концентрации веществ в крови и клетках, рост, размножение и другие процессы. Например, инсулин снижает содержание сахара в крови, гормон роста регулирует рост скелета, лептин регулирует аппетит.
Клетки могут взаимодействуют друг с другом на расстоянии с помощью сигнальных белков, передаваемых через межклеточное вещество. К таким белкам относятся цитокины, факторы роста и др.
Цитокины — небольшие пептидные информационные молекулы. Они регулируют взаимодействия между клетками, определяют жизнедеятельность клеток, их выживаемость, стимулируют или подавляют рост, дифференциацию, функциональную активность и апоптоз (явление программируемой клеточной смерти), обеспечивают согласованность и упорядоченность действий иммунной, эндокринной и нервной систем. Примером цитокинов может служить фактор некроза опухолей|, который передаёт сигналы воспаления между клетками организма
Регуляторная функция
[править]Регуляторная функция белков ― осуществление белками регуляции процессов в клетке или в организме, что связано с их способностью к приему и передаче информации. Действие регуляторных белков обратимо и, как правило, требует присутствия лиганда. Постоянно открывают все новые и новые регуляторные белки, в настоящее время известна, вероятно, только малая их часть.
Существует несколько разновидностей белков, выполняющих регуляторную функцию:
- белки — рецепторы, воспринимающие сигнал (см. раздел "Рецепторная функция)
- сигнальные белки — гормоны и другие вещества, осуществляющие межклеточную сигнализацию (многие, хотя и далеко не все, из них является белками или пептидами) (см. раздел «Сигнальная функция»)
- регуляторные белки, которые регулируют многие процессы внутри клеток.
Белки регулируют процессы, происходщие внутри клеток, при помощи нескольких механизмов:
- взаимодействия с молекулами ДНК (транскрипционные факторы)
- при помощи фосфорилирования (протеинкиназы) или дефосфорилирования (протеинфосфатазы) других белков
- при помощи взаимодействия с рибосомой или молекулами РНК (факторы регуляции трансляции)
- воздействия на процесс удаления интронов (факторы регуляции сплайсинга)
Белки-регуляторы транскрипции
Транскрипционный фактор — это белок, который, попадая в ядро клетки, регулирует транскрипцию ДНК, то есть синтез мРНК по матрице ДНК. Некоторые транскрипционные факторы изменяют структуру хроматина, делая его более доступным для РНК-полимераз. Существуют различные вспомогательные транскрипционные факторы, которые создают нужную конформацию ДНК для последующего действия других транскрипционных факторов. Еще одна группа транскрипционных факторов — это те факторы, которые не связываются непосредственно с молекулами ДНК, а объединяются в более сложные комплексы с помощью белок-белковых взаимодействий.
Факторы регуляции трансляции
Трансляция — синтез полипептидных цепей белков по матрице мРНК, выполняемый рибосомами. Регуляция трансляции может осуществляться несколькими способами, в том числе и с помощью белков-репрессоров, которые связываются с мРНК. Известно много случаев, когда репрессором является белок, который кодируется этой мРНК. В этом случае происходит регуляция по типу обратной связи (примером этого может служить репрессия синтеза фермента треонил-тРНК-синтетазы).
Факторы регуляции сплайсинга
Внутри генов эукариот есть участки, не кодирующие аминокислот. Эти участки называются интронами. Они сначала переписываются на пре-мРНК при транскрипции, но затем вырезаются особым ферментом. Этот процесс удаления интронов, а затем последующее сшивание концов оставшихся участков называют сплайсингом (сшивание, сращивание). Существует альтернативный сплайсинг, при котором из одной пре-м-РНК могут образовываться несколько разных хрелых м-РНК. Сплайсинг осуществляется с помощью небольших РНК, обычно связанных с белками, которые называются факторами регуляции сплайсинга. В сплайсинге принимают участие белки, обладающие ферментативной активностью. Они придают пре-мРНК нужную конформацию. Для сборки комплекса(сплайсосомы) необходимо потребление энергии в виде расщепляемых молекул АТФ, поэтому в составе этого комплекса есть белки, обладающие АТФ-азной активностью.
Особенности сплайсинга определяются белками, способными связываться с молекулой РНК в областях интронов или участках на границе экзон-интрон. Эти белки могут препятствовать удалению одних интронов и в то же время способствовать вырезанию других. Направленная регуляция сплайсинга может иметь значительные биологические последствия. Например, у плодовой мушки дрозофилы альтернативный сплайсинг лежит в основе механизма определения пола.
Протеинкиназы и протеинфосфатазы
Важнейшую роль в регуляции внутриклеточных процессов играют протеинкиназы — ферменты, которые активируют или подавляют активность других белков путем присоединения к ним фосфатных групп.
Протеинкиназы регулируют активность других белков путем фосфорилирования — присоединения остатков фосфорной кислоты к остаткам аминокислот, имеющих гидроксильные группы. При фосфорилировании обычно изменяется функционирование данного белка, например, ферментативная активность, а также положение белка в клетке.
Существуют также протеинфосфатазы — белки, которые отщепляют фосфатные группы. Протеинкиназы и протеинфосфатазы регулируют обмен веществ, а также передачу сигналов внутри клетки. Фосфорилирование и дефосфорилирования белков — один из главных механизмов регуляции большинства внутриклеточных процессов.
Каталитическая функция белков. Обмен веществ и энергии как совокупность ферментативных реакций
[править]Ферменты, или энзи́мы (от лат. fermentum, греч. ζύμη, ἔνζυμον — дрожжи, закваска) — обычно белковые молекулы или молекулы РНК (рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых системах. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами. Белковые ферменты синтезируются на рибосомах, а РНК — в ядре.
Термины «фермент» и «энзим» давно используют как синонимы (первый в основном в русской и немецкой научной литературе, второй — в англо- и франкоязычной).
Наука о ферментах называется энзимологией.
Ферменты специфичны к субстратам (АТФаза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу).
Ферменты обычно проявляют высокую специфичность по отношению к своим субстратам (субстратная специфичность). Это достигается частичной комплементарностью формы, распределения зарядов и гидрофобных областей на молекуле субстрата и в центре связывания субстрата на ферменте. Ферменты обычно демонстрируют также высокий уровень стереоспецифичности (образуют в качестве продукта только один из возможных стереоизомеров или используют в качестве субстрата только один стереоизомер), региоселективности (ообразуют или разрывают химическую связь только в одном из возможных положений субстрата) и хемоселективности (катализируют только одну химическую реакцию из нескольких возможных для данных условий). Несмотря на общий высокий уровень специфичности, степень субстратной и реакционной специфичности ферментов может быть различной. Например, эндопептидаза трипсин разрывает пептидную связь только после аргинина или лизина, если за ними не следует пролин, а пепсин гораздо менее специфичен и может разрывать пептичную связь, следующую за многими аминокислотами.
Активность ферментов определяется их трёхмерной структурой. Как и все белки, ферменты синтезируются в виде линейной цепочки аминокислот, которая сворачивается определённым образом. Каждая последовательность аминокислот сворачивается особым образом, и получающаяся молекула (белковая глобула) обладает уникальными свойствами. Многие ферменты обладают сложной четвертичной структурой.
Механизм работы ферментов
Чтобы катализировать реакцию, фермент должен связаться с одним или несколькими субстратами. Белковая цепь фермента сворачивается таким образом, что на поверхности глобулы образуется щель, или впадина, где связываются субстраты. Эта область называется сайтом связывания субстрата. Обычно он совпадает с активным центром фермента или находится вблизи него. Некоторые ферменты содержат также сайты связывания кофакторов (коферментов, ионов металлов, АТФ и др.).
Фермент, соединяясь с субстратом:
- очищает субстрат от водяной «шубы»
- располагает реагирующие молекулы субстратов в пространстве нужным для протекания реакции образом
- подготавливает к реакции (например, поляризует) молекулы субстратов.
Обычно присоединение фермента к субстрату происходит за счет ионных или водородных связей, редко — за счет ковалентных. В конце реакции её продукт (или продукты) отделяются от фермента.

В результате фермент снижает энергию активации реакции. Это происходит потому, что в присутствии фермента реакция идет по другому пути (фактически происходит другая реакция), например:
В отсутствии фермента:
- А+В = АВ
В присутствии фермента:
- А+Ф = АФ
- АФ+В = АВФ
- АВФ = АВ+Ф
где А, В — субстраты, АВ — продукт реакции, Ф — фермент.
Модель «ключ-замок»

В 1890 г. Эмиль Фишер предположил, что специфичность ферментов определяется точным соответствием формы фермента и субстрата. Такое предположение называется моделью «ключ-замок». Фермент соединяется с субстратом с образованием короткоживущего фермент-субстратного комплекса. Однако, хотя эта модель объясняет высокую специфичность ферментов, она не объясняет явления стабилизации переходного состояния, которое наблюдается на практике.
Регуляция работы ферментов
[править]Ферментативная активность может регулироваться активаторами и ингибиторами ферментов (активаторы — повышают, ингибиторы — понижают).
- [51] Анимация «Снижение энергии активации: роль ферментов» (англ. текст)
Основные молекулярно-генетические процессы
[править][52] — Структура и организация генома. И. Ф. Жимулев
Роль ДНК в клетке и история её открытия
[править]
Нуклеиновые кислоты открыл Ф. Мишер в XIX веке
[править]ДНК как представитель отдельного класса органических веществ — нуклеиновых кислот — была открыта швейцарским врачом и биологом Фридрихом Мишером в 1869 г. Мишер изучал химический состав гноя — погибших клеток-лейкоцитов. Ему удалось выделить из ядер лейкоцитов вещество, не расщепляемое протеазами, не растворяющееся в эфире и содержащее большое количество фосфора. Мишер назвал его «нуклеин» (от слова «нуклеус» — ядро) (когда это вещество было переименовано в «нуклеиновую кислоту», это вызвало большое недовольство Мишера). Позднее Мишеру удалось найти удобный материал для выделения ДНК — молоки лососевых рыб (для выделения больших количества ДНК их используют до сих пор, так как процентное содержание ДНК в сперматозоидах гораздо выше, чем в любых других клетках).
А. Вейсман предположил, что существует «бессмертная» зародышевая плазма — особое вещество наследственности
[править]В конце 19-ого века А. Вейсман высказал гипотезу, что существует особое «наследственное вещество», которое он назвал зародышевой плазмой. Она, как предполагал Вейсман, находится в хромосомах, а её элементы располагаются в линейном порядке. Две гипотезы, которые он выдвинул, подтвердились в ходе развития генетики:
1) Вейсман предположил, что зародышевая плазма содержится только в половых клетках и отсутствует в соматических (клетках тела). Как предполагал Вейсман, зародышевая плазма не зависит от того, что происходит с соматическими клетками (приобретенные признаки не наследуются). Для доказательства этой теории Вейсман проводил опыты на мышах. В двадцати поколениях мышам подрезали хвосты, но при этом у их детенышей хвосты короткими не становились. Этот несколько наивный опыт в то время рассматривался как важное доказательство того, что приобретенные признаки не наследуются: клетки тела не могут сообщить половым клеткам о происходящих с ними изменениях.
2) Идея Вейсмана о роли хромосом и о линейном расположении в них элементарных единиц наследственности оказалась верной и сохранилась в науке до наших дней, изменилась только терминология.
Генетические опыты на дрозофиле показали, что гены расположены в хромосомах в линейной последовательности
[править]Открытие кроссинговера (обмена участками между гомологичными хромосомами) не только внесло поправку в представления о сцепленном наследовании. После этого открытия ученые смогли изучить расположение генов в хромосоме. Идея была предложена ученым Т. Х. Морганом и его сотрудником Стертевантом. Они предположили, что: 1) Хромосома представляет собой линейную структуру. 2) Гены в хромосоме расположены линейно, как бусины на нитке. 3) Точка пересечения хромосом при кроссинговере лежит в любом месте хромосом.
Из этих предположений можно сделать вывод, что чем дальше гены расположены друг от друга, тем чаще будет наблюдаться кроссинговер, чем гены ближе друг к другу, тем кроссинговер будет наблюдаться реже. Если гены лежат на разных концах хромосомы, то при каждом перекрещивании гены разойдутся в разные хромосомы, но если гены расположены близко друг к другу, то кроссинговер будет происходить только если точка перекреста хромосом окажется на коротком участке, находящемся между ними между ними, то есть редко.
Если изучать кроссинговер трех генов, то можно определить расстояние между ними по частоте кроссинговеров. Морган скрещивал самок дрозофил с рецессивными генами w (белые глаза), y (желтый цвет тела)и bi (вильчатые крылья). При этом частота кроссинговеров между генами y и w составила 1,2 %, между генами w и bi — 3,5 %, между генами y и bi — 4,7 %. Из этого можно сделать вывод, что ген w находится между генами y и bi, причем расстояние между данными генами пропорционально проценту кроссинговеров меду ними.
Н. К. Кольцов предсказал, что наследственная информация записана на молекулярном уровне, а наследственные молекулы размножаются в помощью матричного принципа
[править]В 1927 году Н. К. Кольцов, выступая с докладом, прибавил к двум уже существующим биологическим принципам («Omne vivum ex ovo», «Omnis cellula ex cellula») третий — «Omnis molecula ex molecula» — «Всякая молекула от молекулы». Речь шла о «наследственных молекулах», которые, как считал Кольцов, несут наследственную информацию. По представлениям Кольцова, «наследственные молекулы» — это белковые макромолекулы огромной длины; информация в них шифруется последовательностью аминокислот. При удвоении хромосом информация копируется по матричному принципу: исходная молекула служит матрицей, по которой строится её копия. В том, что наследственная информация закодирована в белках, Кольцов ошибся (одной из причин этого было кажущееся исчезновение ДНК при позднем овогенезе и в гигантских хромосомах). Зато в том, что «наследственная молекула» удваивается по матричному принципу, он оказался прав.
Э. Шрёдингер стимулировал интерес биологов к физической природе наследственности
[править]Эрвин Шрёдингер — один из создателей квантовой механики — в 1944 г. написал книгу «Что такое жизнь? С точки зрения физика». В этой книге автор подробно описывает строение хромосом и их функцию. Он подробно разобрал явление мутаций и их причины. Также он разработал некоторые положения теории наследственности. Вот некоторые выдержки из его книги: «Именно эти хромосомы или, возможно, только осевая или скелетная нить того, что мы видим под микроскопом как хромосому, содержат в виде своего рода шифровального кода весь „план“ будущего развития индивидуума и его функционирования в зрелом состоянии. Каждый полный набор хромосом содержит весь шифр, поэтому, как правило, имеются две копии последнего в оплодотворенной яйцеклетке, которая представляет самую раннюю стадию будущего индивидуума…»
«Называя структуру хромосомных нитей шифровальным кодом, мы подразумеваем, что всеохватывающий ум, вроде такого, который некогда представлял себе Лаплас и которому каждая причинная связь непосредственно открыта, мог бы, исходя из структуры хромосом, сказать, разовьется ли яйцо при благоприятных условиях в черного петуха или в крапчатую курицу, в муху или растение маиса, в рододендрон, жука, мышь или человека…»
По этим цитатам видно, что Шредингер разбирал темы, которые раньше почти не затрагивались биологической теорией. Здесь Шредингер впервые использует для хромосом термин «наследственный шифровальный код». Шрёдингер был знаменитым физиком, и его книга вызвала неподдельный интерес у других представителей естественных наук, в том числе у биологов, хотя многие не сразу оценили ее значение.
[53] Э.Шредингер. Что такое жизнь? С точки зрения физика. (Русский перевод)
Ф. Гриффит открыл трансформацию: вещества убитых бактерий могут вызывать изменение наследственных свойств других штаммов, проникая в их клетки
[править]
.

Немецкий бактериолог Фред Нойфельд впервые описал штаммы пневмококка Streptococcus pneumoniae. Среди колоний вирулентных (способных вызывать заболевание) пневмококков, имеющих гладкую поверхность (R-штамм) изредка в результате мутации появляются шероховатые колонии невирулентного S-штамма. Утрата болезнетворности связана с тем, что мутантные пневмококки не синтезируют полисахаридную капсулу. Сейчас известно, что полисахаридная капсула препятствует опсонизации и последующему фагоцитированию бактерий.
До эпохи антибиотиков пневмония была грозной, часто смертельной болезнью. Нужно отметить, что и сегодня пневмония занимает одно из первых мест среди инфекционных болезней как причина смертности. В наши дни существует и в некоторых странах широко применяется вакцина от пневмонии.
Английский врач и генетик Фредерик Гриффит начал опыты, приведшие к открытию трансформации, а надежде получить вакцину от пневмонии. Пневмококки — один из самых обычных возбудителей, которые вызывают эту болезнь. Результаты своих экспериментов Ф. Гриффит опубликовал в 1928 году.
Гриффит брал два штамма пневмококков: капсульный и бескапсульный. Капсульный — патогенный (болезнетворный), при инфицировании таким штаммом мыши погибают через 1-2 дня, бескапсульный — непатогенный. При введении мышам смеси убитых нагреванием (и, следовательно, потерявших болезнетворность) капсульных пневмококков и живых бескапсульных (непатогенных) бактерий животные погибали в результате размножения в их организме капсульных болезнетворных форм.
Следовательно, убитые пневмококки с капсулой каким-то образом передавали свой наследственный признак (способность синтезировать капсулу) бескапсульному штамму. Эта способность сохранялась и у последующих поколений при разведении. Обнаруженное явление Гриффит назвал трансформацией.
Описание опытов Гриффита:
1) После заражения пневмококками капсульного патогенного(штамма мыши погибают. Капсульные пневмококки размножаются в их крови и могут быть выделены в чистую культуру.
2) При инфицировании пневмококками бескапсульного непатогенного штамма животные не погибают. Бескапсульные пневмококки уничтожаются иммунной системой мыши и не обнаруживаются в её крови.
3) После заражения пневмококками капсульного патогенного штамма, предварительно убитыми нагреванием, мыши не погибают. Убитые пневмококки, естественно, не размножаются.
4) При введении мышам одновременно бескапсульных неболезнетворных пневмококков и капсульных, убитых нагреванием, животные погибают. Бескапсульные пневмококки становятся капсульными и размножаются в организме мыши. выделенные из её организма в чистую культуру, они и в последующих попоклениях сохраняют способность синтезировать капсулу.
Бескапсульные неболезнетворные пневмококки приобрели наследуемый признак убитых капсульных бактерий — произошла трансформация.
В 1941 г Ф. Гриффит погиб в своей лаборатории в пригороде Лондона во время бомбежки.
До исследований Гриффита бактериологи полагали, что штаммы не изменяются от поколения к поколению. Данные, полученные Гриффитом, позднее были подтверждены Фредом Нойфельдом в Институте Коха и Мартином Генри Доусоном в Институте Рокфеллера. Мартин Генри совместно с Ричардом Сиа разработал метод трансформации клеток бактерий in vitro (эксперимент Гриффита был проделан в условиях in vivo). После отъезда Доусона в 1930 году Джеймс Эллоуэй в 1933 году предпринял попытки продолжить исследования Гриффитса и получить водный экстракт трансформирующего агента. Колин Маклеод работал над выделением этих водных растворов с 1934 по 1937 год, исследования по выделению фракций были продолжены в 1940 году и завершены Маклином Маккарти.
В 1944 г. эта серия экспериментов была завершена Освальдом Эйвери, Колином МакЛеодом и Маклином МакКарти. Они смешивали бескапсульных пневмококков со взятыми от капсульных белками, полисахаридами или ДНК. При введении смеси из бескапсульных пневмококков и белков или полисахаридов животные оставались живы; значит, наследственная информация в них не содержится. А при введении смеси из бескапсульных пневмококков и ДНК мыши умирали; значит, именно в ДНК и записана информация, определяющая способность синтезировать капсулу.
Опыт Эйвери, МакЛеода и МакКарти доказал, что трансформирующее начало — ДНК
[править]Эксперимент Освальда Эвери, Колина Маклеод и Маклина Маккарти, проиведенный в 1944 году, доказал что ДНК является веществом, вызывающим трансформацию клеток бактерий, то есть передает некоторый наследственный признак.
Эксперимент Эвери, Маклеода и Маккарти стал кульминацией исследований, проводившихся в Рокфеллеровском институте медицинских исследований в 1930-х — 1940-х годах и начатых экспериментом Гриффита в 1928 году. В эксперименте Гриффита убитые пневмококки штамма III-S (обладают олигосахаридной капсулой, вирулентные), введенные в кровь мыши с живыми пневмококками штамма II-R (безкапсульные, невирулентные), вызывали инфекцию типа III-S (мышь погибала). В статье, опубликованной в феврале 1944 года в Журнале экспериментальной медицины, Эвери с соавторами показали, что ДНК, но не белки являются веществом, отвечающим за передачу наследственных признаков у бактерий.

В ходе эксперимента болезнетворные пневмококки, имеющие капсулу, были убиты нагреванием. Для выделения ДНК было произведено осаждение белков хлороформом. Полисахаридные капсулы, обуславливающие вредные свойства бактерий, были гидролизованы специфичным ферментом. Из оставшейся части экстракта были выделены прозрачные тяжи. Химический анализ показал, что соотношение в них атомов углерода, водорода, азота и фосфора соответствует соотношению этих же атомов в молекуле ДНК. Для подтверждения того, что действующим началом трансформации является именно ДНК, а не РНК, белки или другие компоненты клетки, Эвери с сотрудниками добавляли к выделенному веществу трипсин (расщепляет пептиды и белки) и рибонуклеазу (разрушает РНК), но это никак не влияло на трансформирующие свойства. Лишь обработка ДНКазой (разрушает ДНК) приводила к разрушению трансформирующего начала.
Опыт Херши и Чейз: при заражении бактерий бактериофаг вводит внутрь клетки ДНК, но не белки
[править]Эксперимент Херши—Чейз окончательно доказал, что носитель генетической информации — это ДНК. Эксперимент состоял из серии опытов, которые были проведены в 1952 году американскими генетиками Алфредом Херши и Мартой Коулз Чейз. Хотя ДНК была известна ещё с 1869 года, ко времени эксперимента многие учёные считали, что наследственная информация находится в белках.

Эксперимент проводился на бактериофаге T2, структура которого к тому времени была выяснена с помощью электронной микроскопии. Оказалось, что бактериофаг состоит из белковой оболочки, внутри которой находится ДНК. Эксперимент был спланирован таким образом, чтобы выяснить, что же — белок или ДНК — является носителем наследственной информации.
Херши и Чейз выращивали две группы бактерий: одну в среде, содержащей радиоактивный фосфор-32 в составе фосфат-иона, другую — в среде с радиоактивной серой-35 в составе сульфат-иона. Бактериофаги, добавленные в среду с бактериями и размножавшиеся в них, поглощали эти радиоактивные изотопы, которые служили маркёрами, при построении своей ДНК и белков. Фосфор содержится в ДНК, но отсутствует в белках, а сера, наоборот, содержится в белках (точнее в двух аминокислотах: цистеин и метионин), но её нет в ДНК. Таким образом, одни бактериофаги содержали меченые серой белки, а другие — меченую фосфором ДНК.
После выделения радиоактивно-меченых бактериофагов их добавляли к культуре свежих (не содержащих изотопов) бактерий и позволяли бактериофагам инфицировать эти бактерии. После этого среду с бактериями подвергали энергичному встряхиванию в специальном смесителе (было показано, что при этом оболочки фага отделяются от поверхности бактериальных клеток), а затем инфицированных бактерий отделяли от среды. Когда в первом опыте к бактериям добавлялись меченые фосфором-32 бактериофаги, оказалось, что радиоактивная метка находилась в бактериальных клетках. Когда же во втором опыте к бактериям добавлялись бактериофаги, меченые серой-35, то метка была обнаружена во фракции среды с белковыми оболочками, но её не было в бактериальных клетках. Это подтвердило, что материалом, которым инфицировались бактерии, является ДНК. Поскольку внутри инфицированных бактерий формируются полные вирусные частицы, содержащие белки вируса, данный опыт был признан одним из решающих доказательств того факта, что генетическая информация (информация о структуре белков) содержится в ДНК.
В 1969 году Алфред Херши получил Нобелевскую премию за открытия генетической структуры вирусов.
[54] Анимация «Опыт Эйвери, Маклеода и Маккарти (трансформирующее начало — это ДНК)» (англ.)
Строение двойной спирали ДНК
[править]Мономеры ДНК — дезоксирибонуклеотиды
[править]Дезоксирибонуклеотиды — мономеры ДНК. Каждый дезоксирибонуклеотид состоит из азотистого основания, остатка фосфорной кислоты и пятиуглеродного сахара (дезоксирибозы).

Они отличаются от рибонуклеотидов строением пятиуглеродного сахара (дезоксирибоза или рибоза). Между собой дезоксирибонуклеотиды отличаются только азотистыми основаниями (аденин, гуанин, цитозин, тимин), которые присоединяются к 1' атому дезоксирибозы ковалентной связью. Дезоксирибонуклеотиды одной цепи соединены между собой ковалентной связью, возникающей между фосфатной группой одного и 3' атомом углерода другого дезоксирибонуклеотида. Между азотистыми основаниями дезоксирибонуклеотидов двух разных цепочек образуется три или две водородные связи (гуанин связывается с цитозином тремя связями, а аденин с тимином двумя).
Азотистые основания нуклеотидов ДНК — аденин, гуанин, тимин и цитозин
[править]К азотистым основаниям относят аденин (A), гуанин (G), цитозин (C) и тимин (T), который входит в состав только ДНК, а урацил (U) заменяет его в РНК. Они обладают схожими структурами и химическими свойствами. Это гетероциклические органические соединения, производные пиримидина и пурина, входящие в состав нуклеотидов. Аденин и гуанин — производные пурина, а цитозин, урацил и тимин — производные пиримидина.
Когда азотистые основания присоединяются ковалентной связью к 1' атомам рибозы (в РНК) или дезоксирибозы (в ДНК), а к 5'-гидроксильной группе сахара присоединяется одна или несколько фосфатных групп, образуются нуклеотиды.
стандартные нуклеотиды ДНК составляют триплеты — участки ДНК, кодирующие одну аминокислоту. Например, с триплета АУГ (ему соответствует аминокислота метионин) обычно начинается синтез белка на рибосомах.
В таблице приведена структура главных азотистых оснований.
| Азотистое основание |
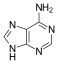 Аденин |
 Гуанин |
 Тимин |
 Цитозин |
 урацил |
| Нуклеозид |  Аденозин A |
 Гуанозин G |
 Тимидин T |
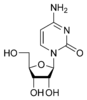 Цитидин C |
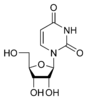 Уридин U |
Нуклеозиды, приведённые в таблице, входят в состав моно-, ди- и трифосфатов. Например, аденозин входит в состав АТФ — важнейшего энергетического ресурса организма.
Пуринs C5N4H4 — гетероциклические соединения, имидазольные производные пиримидинов. Производные пурина играют важную роль в химии природных соединений (пуриновые основания ДНК и РНК; кофермент NAD; алкалоиды, кофеин и т. д.) и, благодаря этому, в фармацевтике — ядро пурина входит в состав некоторых антибиотиков. Пурин и ряд его производных обладают противоопухолевой, противовирусной и противоаллергической активностью.
В таблице приведены производные пурина.
Аденин — азотистое основание, аминопроизводное пурина. Образует две водородных связи с урацилом (в РНК) и тимином (в ДНК) по правилу комплементарности.
Представляет собой бесцветные кристаллы. Химическая формула С5H5N5. Аденин проявляет основные свойства.
Аденин входит в состав многих жизненно важных для живых организмов соединений, таких как аденозин, аденозинфосфорные кислоты, нуклеиновые кислоты, адениновые нуклеотиды и др. В виде этих соединений аденин широко распространен в живой природе.
Гуанин — азотистое основание, аминопроизводное пурина, является составной частью нуклеиновых кислот. Химическая формула — C5H5N5O.
В ДНК и РНК образует три водородные связи с цитозином по правилу комплементарности. Производные гуанилового нуклеотида — ГДФ, ГТФ и цАМФ — участвуют во многих сигнальных путях клетки. Для некоторых процессов, происходящих в клетке — например, для сборки микротрубочек — ГТФ используется как источник энергии.
Пиримидин C4N2H4 — гетероциклическое соединение, имеющее плоскую молекулу, простейший представитель диазинов.
Пиримидин представляет собой бесцветные кристаллы с характерным запахом. Пиримидин проявляет свойства слабого двукислотного основания, так как атомы азота могут присоединять протоны. Производные пиримидина широко распространены в живой природе, где участвуют во многих важных биологических процессах. Его производные цитозин, тимин, урацил входят в состав нуклеотидов.
Биологическая роль пиримидинов не ограничена нуклеиновыми кислотами. Некоторые пиримидиновые нуклеотиды играют важную роль в процессах обмена углеводов и липидов. Витамин В1 (тиамин) — пиримидиновое производное. Пиримидиновое ядро входит в состав некоторых коферментов и антибиотиков.
Тимин — производное пиримидина. Формула C5H6N2O2.
Присутствует во всех живых организмах, где вместе с дезоксирибозой входит в состав нуклеозида тимидина, который может фосфорилироваться 1-3 остатками фосфорной кислоты с образованием нуклеотидов тимидин моно-, ди- или трифосфорной кислоты (ТМФ, ТДФ и ТТФ).
Дезоксирибонуклеотиды тимина входят в состав ДНК, в РНК на его месте располагается рибонуклеотид урацила. Тимин комплементарен аденину, образует с ним 2 водородные связи.
Цитозин — азотистое основание, производное пиримидина. С рибозой образует нуклеозид цитидин, входит в состав нуклеотидов ДНК и РНК. Во время репликации и транскрипции по правилу комплементарности образует три водородных связи с гуанином.
Представляет собой бесцветные кристаллы. Химическая формула C4H5N3O. Его производные цитозин, тимин, урацил входят в состав нуклеотидов, проявляет основные свойства.
Урацил — пиримидиновое основание, которое является компонентом рибонуклеиновых кислот (РНК) и, как правило, отсутствует в дезоксирибонуклеиновых кислотах (ДНК). В составе РНК может комплементарно связываться с аденином, образуя две водородные связи.
Эрвин Чаргафф открыл правила, описывающие количественные соотношения нуклеотидов
[править]Правило Чаргаффа — биологический закон, в соответствии с которым установлены количественные соотношения между азотистыми основаниями разных типов. Для того, чтобы определить точные количественные соотношения нуклеотидов, Чаргафф разделил нуклеотиды ДНК методом бумажной хроматографии. Ему удалось выявить три закономерности:
- Число аденинов равно числу тиминов, а число гуанинов — числу цитозинов: А=Т, Г=Ц
- Число пуринов равно числу пиримидинов: А+Г=Т+Ц
- Число аденина и цитозина равно числу гуанина и тимина: А+Ц=Г+Т
Состав ДНК разных организмов различается суммарным числом комплементарных оснований. Соотношение комплементарных нуклеотидов тоже может быть различным в разных молекулах ДНК. У одних оорганизмов в ДНК преобладают пары аденин-тимин, а у других — гуанин-цитозин. При этом правила Чаргаффа будут выполняться в любом случае.
- Вопрос
- Если в ДНК содержится 21 % аденина, то какова долю (%) остальных нуклеотидов, содержащихся в ДНК?
Данные рентгеноструктурного анализа показали, что молекулы ДНК имеют спиральную структуру
[править]В 50-х годах 20 века многие химики и биологи пытались исследовать структуру ДНК. В Королевском колледже в Лондоне Морис Уилкинс и Розалинда Франклин пытались решить эту проблему методом рентгеноструктурного анализа солей ДНК. Но такой способ позволял выявить только общую структуру молекулы. Тем временем Джеймс Уотсон и Френсис Крик в Кавендишской лаборатории Кембриджского университета, используя данные, полученные М. Уилкинсом, стали строить пространственные 3-D модели ДНК. Они пытались создать структуру, которая согласовывалась бы со всеми данными рентгеноструктурного анализа. В итоге Уотсон и Крик пришли к выводу, что ДНК имеет спиральную структуру с периодичностью 0,34 нм вдоль оси.
В 1953 году Дж. Уотсон и Ф. Крик открыли строение ДНК, предложив модель двойной спирали
[править]Нуклеиновые кислоты, подобно белкам, обладают первичной структурой (под которой подразумевается их нуклеотидная последовательность) и трехмерной структурой. Интерес к структуре ДНК усилился, когда в начале XX века возникло предположение, что ДНК, возможно, представляет собой генетический материал.
В начале 50-х годов американский химик, лауреат Нобелевской премии Лайнус Полинг, уже изучивший к тому времени α-спиральную структуру, характерную для многих фибриллярных белков, обратился к исследованию структуры ДНК, которая по имеющимся в то время сведениям также представлялась фибриллярной молекулой. Одновременно в Королевском колледже Морис Уилкинс и Розалинда Франклин пытались решить ту же проблему методом рентгеноструктурного анализа. Их исследования требовали долгой и трудоёмкой работы по приготовлению чистых препаратов солей ДНК, для которых удавалось получать сложные дифракционные картины. С помощью этих картин можно было, однако, выявить лишь общую структуру молекулы ДНК, не столь детализированную, как та, которую позволяли получить чистые кристаллы белка.
Тем временем Фрэнсис Крик и Джеймс Уотсон в Кавендишской лаборатории Кембриджского университета избрали иной подход, который в конечном счёте и обеспечил успешное решение проблемы. Используя все физические и химические данные, какие оказались в их распоряжении, Уотсон и Крик стали строить пространственные модели ДНК в надежде на то, что рано или поздно им удастся получить достаточно убедительную структуру, согласующуюся со всеми этими данными. Истории их поисков увлекательно описаны Уотсоном в его книге «Двойная спираль»[55].
Два обстоятельства оказались для Уотсона и Крика решающими. Во-первых, они имели возможность регулярно знакомиться с результатами работ Уилкинса и, сопоставляя с его рентгенограммами свои модели, могли таким образом проверять эти модели. А рентгенограммы Уилкинса свидетельствовали в пользу спиральной структуры с периодичностью 0,34 нм вдоль оси. Во-вторых, Уотсон и Крик отдавали себе отчёт в важном значении закономерностей, касающихся соотношения различных оснований в ДНК. Обнаружил эти закономерности и сообщил о них в 1951 году Эрвин Чаргафф. Это открытие, однако, при всей своей важности не привлекло к себе должного внимания.
Уотсон и Крик задались целью проверить предположение, что молекула ДНК состоит из двух спиральных полинуклеотидных цепей, удерживаемых вместе благодаря спариванию оснований, принадлежащих соседним цепям. Основания удерживаются вместе водородными связями. Аденин спаривается с тимином, гуанин — с цитозином; АТ-пара соединяется двумя водородными связями, а ГЦ-пара — тремя. Уотсон попытался представить себе такой порядок спаривания оснований и позже вспоминал об этом так: «От радости я почувствовал себя на седьмом небе, ибо тут я уловил возможный ответ на мучившую нас загадку: почему число остатков пуринов в точности равно числу остатков пиримидинов?»
Уотсон увидел, что при таком сочетании основания оказываются очень точно подогнанными друг к другу, а общий размер и форма этих двух пар оснований одинаковы, так как обе пары содержат по три кольца. Водородные связи при других сочетаниях оснований в принципе возможны, но они гораздо слабее. После того как все эти обстоятельства выяснились, можно было наконец приступить к созданию достоверной модели ДНК.
Уотсон и Крик показали, что ДНК состоит из двух антипараллельных (направленных в противоположные стороны) полинуклеотидных цепей. Каждая цепь закручена в спираль вправо, и обе они свиты вместе, то есть закручены вправо вокруг одной и той же оси, образуя двойную спираль. Каждая цепь состоит из сахарофосфатного остова, вдоль которого перпендикулярно длинной оси спирали располагаются азотистые основания. Находящиеся друг против друга основания двух противоположных цепей двойной спирали связаны между собой водородными связями. Расстояние между сахарофосфатными остовами двух цепей постоянно и равно расстоянию, занимаемому парой оснований, то есть одним пурином и одним пиримидином. Два пурина занимали бы слишком много места, а два пиримидина — слишком мало для того, чтобы заполнить промежутки между двумя цепями. Вдоль оси молекулы соседние пары оснований располагаются на расстоянии 0,34 нм одна от другой, чем и объясняется обнаруженная на рентгенограммах периодичность. Полный оборот спирали приходится на 3,4 нм, то есть на 10 пар оснований. Никаких ограничений относительно последовательности нуклеотидов в одной цепи не существует, но в силу правила спариваний оснований эта последовательность в одной цепи определяет собой последовательность нуклеотидов в другой цепи. Поэтому мы говорим, что две цепи двойной спирали комплементарны друг другу.
Уотсон и Крик опубликовали сообщение о своей модели ДНК в журнале «Nature» в 1953 г., а в 1962 г. они вместе с Морисом Уилкинсом были удостоены за эту работу Нобелевской премии. Розалинду Франклин, умершую от рака ранее присуждения этой премии, не включили в число лауреатов, поскольку Нобелевская премия посмертно не присуждается.
Для того чтобы признать, что имеющая предложенную структуру молекула может выполнять роль генетического материала, требовалось показать, что она способна: 1) нести в себе закодированную информацию и 2) точно воспроизводиться (реплицироваться). Уотсон и Крик отдавали себе отчет в том, что их модель удовлетворяет этим требованиям. В конце своей первой статьи они отметили: «От нашего внимания не ускользнуло, что постулированное нами специфическое спаривание оснований сразу же позволяет постулировать и возможный механизм копирования для генетического материала». Во второй статье, опубликованной в том же 1953 году, они обсудили выводы, которые следовали из их модели для возможного механизма передачи наследственной информации. Это открытие показало, сколь явно структура может быть связана с функцией уже на молекулярном уровне. Оно дало начало стремительному развитию молекулярной биологии.
[56]Дж. Уотсон. Двойная спираль. (русский перевод).
Удвоение ДНК
[править]Удвоение ДНК — матричный синтез
[править]
Матричный биосинтез — запрограммированный с помощью нуклеиновых кислот (НК) процесс сборки новых цепей полимеров (нуклеиновые кислоты, используемые как программы в матричном биосинтезе, называют матрицами). Реакции матричного биосинтеза:
- реакция синтеза РНК на ДНК
- удвоение ДНК
- синтез белка на матрице иРНК
Значение реакции матричного синтеза:
- способность к воспроизведению себе подобных
Репликация ДНК — это процесс синтеза дочерней молекулы ДНК. Он происходит в процессе деления клетки на матрице родительской молекулы ДНК. Генетический материал, заключенный в ДНК, удваивается и делится между дочерними клетками. Репликацию ДНК осуществляет специальный фермент — ДНК-полимераза. Цепи ДНК расходятся, и каждая из них становится матрицей. Каждая синтезированная молекула ДНК состоит из одной цепи родительской молекулы и одной вновь синтезированной цепи. Такой механизм удвоения называется полуконсервативным.
Удвоение ДНК — полуконсервативная репликация
[править]Уотсон и Крик предположили, что удвоение ДНК происходит по полуконсервативному механизму. Это означает, что каждой новой двойной спирали одна цепь нуклеотидов достаётся от старой, а вторая цепь достраивается заново. В 1958 г этот механизм был подтвержден в опыте Месельсона и Сталя.

Каждая молекула ДНК содержит множество атомов азота. Наиболее распространён изотоп азота 14N. Существует также изотоп 15N, он не радиоактивен, а лишь тяжелее 14N. Содержащие тяжелый изотоп молекулы ДНК функциональны и могут удваиваться.
Были выращены несколько поколений E. coli в среде, где в качестве источника азота присутствовали соли аммония, содержащие тяжелый изотоп 15N. Затем их ДНК была выделена и центрифугирована в градиенте плотность CsCl. Каждая молекула ДНК останавливалась на том уровне в пробирке, где её плотность совпадает с плотностью раствора соли. При длительном центрифугировании с ускорением около 10.000 g ионы цезия и хлора распределяются в пробирке неравномерно — у дна их концентрация повышается.
ДНК бактерий, выращенных в 15N среде, была более тяжёлой. Эти бактерии затем были помещены обратно в 14N среду, где им было позволено разделится только один раз. Затем из клеток были извлечена ДНК, её плавучая плотность оказалась больше плавучей плотности ДНК бактерий, выращенных в среде, богатой 14N, но меньше плавучей плотности ДНК бактерий, выращенных в 15N среде. Это противоречило гипотезе о консервативном характере репликации ДНК, когда одна дочерняя клетка получает материнскую ДНК, а вторая — вновь синтезированную, обе цепи которой — новые, так как в этом случае ДНК разделилась бы на две фракции — лёгкую, содержащую атомы 14N, и тяжёлую, содержащую 15N.
Однако этот результат не исключал дисперсный механизм репликации, когда куски материнской ДНК распределяются между дочерними ДНК случайным образом. Поэтому было выращено второе поколение бактерий, и их ДНК также была отцентрифугирована в градиенте хлористого цезия. Выяснилось, что клетки содержат в равном количестве как полностью «лёгкие» ДНК, так и «гибридные». Этот факт позволил исключить гипотезу дисперсного механизма репликации.
- Задание 1
- Для проведения этого эксперимента потребовалось получить синхронизированную культуру бактерий — такую культуру, в которой все клетки делятся одновременно. Как вы думаете, зачем?
- Задание 2
- Придумайте способы, с помощью которых можно получить такую культуру. Затем найдите в литературе данные о том, как в действительности получают синхронизированные культуры.
- Задание 3
- Предскажите результаты, которые получили бы Месельсон и Сталь в случае а) консервативного и б) дисперсного механизмов удвоения ДНК, Нарисуйте, как выглядело бы распределение ДНК в градиенте хлористого цезия через одно, два и три деления после переноса в среду с легким изотопом азота в случаях а) и б).
- [57] Анимация «Полуконсервативная репликация ДНК — опыт Месельсона и Сталя» (англ. текст)
Источником энергии для удвоения ДНК служат макроэргические связи трифосфатнуклеотидов
[править]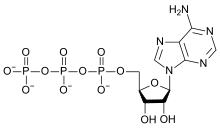
Молекулы трифосфатнуклеотидов (АТФ, ГТФ, ЦТФ, ТТФ) состоят из азотистого основания, сахара дезоксирибозы и трёх остатков ортофосфорной кислоты.
Трифосфатнуклеотиды относятся к макроэргическим соединениям, то есть к химическим соединениям, содержащим связи, при гидролизе которых высвобождается значительное количество энергии. В данном случае запасающие энергию связи — связи между остатками фосфорной кислоты. Гидролиз такой связи, сопровождаемый отщеплением двух остатков, приводит к выделению от 40 до 60 кДж/моль (в зависимости от условий).
При синтезе новой цепочки ДНК из трифосфатнуклеотидов от каждого из них отщепляется два остатка фосфорной кислоты. Выделяющейся при этом энергии хватает на образование ковалентной связи между неотщепившимся остатком фосфорной кислоты и третьим атомом углерода в дезоксирибозе следующего нуклеотида.
Фермент, катализирующий синтез ДНК — ДНК-зависимая ДНК-полимераза
[править]ДНК-зависимые ДНК-полимеразы — это ферменты, осуществляющий репликацию ДНК (удвоение молекул ДНК). ДНК-полимеразы считывают информацию с цепи ДНК и достраивают вторую цепочку нуклеотидов, комплементарных данной, присоединяя к строящейся цепи нуклеотид, комплементарный нуклеотиду матричной цепи. Продукты этой реакции — удлиненная цепь ДНК и пирофосфат. Работа ДНК-полимеразы имеет свои особенности:
- ДНК-полимераза может двигаться только в одну сторону — от 5' к 3'-концу, вследствие чего образуются лидирующая и отстающая цепи.
- ДНК-полимеразе требуется затравка в виде короткого фрагмента РНК (она не может начать синтез цепи нуклеотидов «с нуля», а способна только добавлять нуклеотиды к цепи). Затравку создает фермент праймаза.
- ДНК-полимераза может двигаться только по цепи раскрученной спирали ДНК. Цепи ДНК раскручивает белок геликаза.
В клетке может присутствовать до 4-5 разных типов ДНК-полимераз. У разных групп эукариот и прокариот встречаются альфа-, бета-, дельта-, гамма-, эпсилон-, дзета-, эта- ДНК-полимеразы. Различные ДНК-полимеразы могут выполнять разные функции. У эукариот непосредственно в репликации ДНК участвуют альфа-, дельта- и эпсилон- ДНК-полимеразы. Каждый тип репликационных ДНК-полимераз имеет свою вероятность ошибки при репликации. У эукариот вероятность вставки некомплементарного азотистого основания ДНК-полимеразой альфа равна 1/106, а ДНК-полимеразой эпсилон равна 1/107. Пострепликационные системы репарации снижают вероятность ошибок репликации ещё на порядок.
Одна из самых важных вторичных функций ДНК-полимераз — эксцизионная репарация ДНК (замена некомплементарного основания на комплементарное). Присоединив очередной нуклеотид, ДНК-полимераза как бы «оборачивается назад» и проверяет, образовал ли он правильные водородные связи с нуклеотидом матричной цепи. Если нет — нуклеотид удаляется. За счет этого вероятность вставки некомплементарного нуклеотида снижается до 1/107−1/108.
Например, бета ДНК-полимераза может удалять основание с помощью специфической N-гликозилазы, а ресинтез азотистого основания может производить только в мононуклеотидных брешах [58]; ДНК-полимеразы дельта и эпсилон, вероятно, не могут производить удаление основания, но зато могут производить ресинтез на более протяженных участках. Однако не все типы ДНК-полимераз способны к репарации. ДНК-полимеразы интенсивно исследуются учеными; возможно, будут открыты их новые функции.
В удвоении ДНК участвуют и другие ферменты
[править]
Реплика́ция ДНК — это процесс синтеза дочерней молекулы дезоксирибонуклеиновой кислоты, который происходит в процессе деления клетки на матрице родительской молекулы ДНК. Репликацию ДНК осуществляет фермент ДНК-полимераза (репликация у эукариот осуществляется несколькими разными ДНК-полимеразами).
ДНК-полимераза — фермент, участвующий в репликации ДНК. Ферменты этого класса катализируют полимеризацию дезоксирибонуклеотидов вдоль цепочки нуклеотидов ДНК, которую фермент «читает» и использует в качестве шаблона.
Кроме ДНК-полимераз в процессе редупликации участвуют другие ферменты:
1) Хеликазы перемещаются по сахаро-фосфатному остову нуклеиновых кислот и разрывают водородные связи между комплементарно соединенными основаниями (rep-белок).
2) ДНК-праймаза синтезирует короткий фрагмент РНК, называемый праймером, комплементарный одноцепочечной матрице ДНК.
3) ДНК-лигаза сшивает фрагменты ДНК «отстающей» цепи, образующиеся при репликации.
4) Топоизомераза оборачивается вокруг ДНК и вносит разрыв, который позволяет спирали ДНК вращаться и снимает напряжение. После релаксации, топоизомераза соединяет разорванные концы.
5) ДНК-связывающие белки, которые расплетают ДНК, удерживают матрицу в разведённом состоянии, тем самым не давая восстановиться водородным связям, и вращают молекулу ДНК.
Геликазы расплетают двойную спираль
[править]
Геликазы (от англ. helix — спираль) — ферменты, раскручивающие двойную спираль ДНК с затратой энергии АТФ и ГТФ. ДНК-геликазы — лишь одна из групп геликаз, есть еще РНК-геликазы. ДНК-геликазы участвуют в репликации, транскрипции,репарации и рекомбинации. Геликазы могут быть активны в качестве мономера или димера, хотя, например, геликазы DnaB активны в качестве гексамера (комплекса из шести субъединиц), образующего баранкообразную структуру. Для расплетания спирали нужен один геликазный белок, но для достижения большей скорости раскручивания несколько геликаз могут действовать совместно.
ДНК-геликазы рвут водордные связи между комплементарными нуклеотидами двух цепей, двигаясь при этом в противоположных направлениях (5'->3' или 3'->5'). При этом образуются две одноцепочечные молекулы, которые потом будут служить матрицей для достраивания второй цепи. Образуется структура Y-образной формы, названная репликационной вилкой. Но при таком быстром расплетании нитей, без вращения относительно друг друга, будут образовываться «узелки» — сверхскрученные участки, как на витой веревке, если её пытаться расплести не с конца, а с середины, растягивая. Суперскрученность устраняет специальный фермент ДНК-топоизомераза.
a:мРНК, b: лидирующая цепь, c: отстающая цепь, d: репликационная вилка, e: РНК праймер, f: фрагменты Оказаки
В клетке присутствует много разновидностей геликаз; так, у человека их 24. При нарушении их работы могут возникать болезни: пигментная ксеродерма, синдром Коккейна, синдром Блума, синдром Вернера.
По характеру и последствиям мутации можно объединить синдром Блума и синдром Вернера в одну группу, а синдром Коккейна и пигментную ксеродерму — в другую.
При синдроме Вернера происходят мутации в гене WRN, кодирующем ДНК-геликазу. Эта мутация вызывает нарушение процесса репарации и репликации, нестабильность генома, 10-кратное увеличение темпа мутаций и уменьшение потенциала делений клеток в культуре.
При синдроме Блума мутация происходит в гене BLM, принадлежащем к генам ДНК-геликаз. Синдром Блума также характеризуется нестабильностью генома и повышенным риском канцерогенеза.
При синдроме Коккейна, сходном с пигментной ксеродермой, основная причина заболевания — дефект одного из механизмов эксцизионной репарации нуклеотидов. При разных вариантах синдрома Коккейна причиной заболевания бывает нарушение функций нескольких генов (CSA,CSB,XPD,XPB,XPG), причём мутации в 3 последних генах бывают и при пигментной ксеродерме. Это заболевание вызвано тем, что после повреждений клеток кожи ультрафиолетовым облучением ДНК фибробластов не восстанавливается.
И при пигментной ксеродерме основная причина заболевания — дефекты раннего этапа эксцизионной репарации нуклеотидов. Мутации происходят в разных генах, кодирующих геликазы — от XPA до XPG. Однако основные причины пигментной ксеродермы — два вида нарушений генотипа: недостаток фермента УФ-эндонуклеазы, опознающего участки, поврежденные УФ-излучением, или дефект ДНК-полимеразы, участвующей в соединении разрывов ДНК (разрывы обычно появляются из-за повреждений кожи, вызванных УФ-облучением (как и при синдроме Коккейна)). Так что при синдроме Коккейна и пигментной ксеродерме мутации, связанные с ДНК-геликазами, не являются основными.
Топоизомеразы разрезают и сшивают нить ДНК, позволяя спирали раскручиваться
[править]Топоизомеразы (topoisomerases) — класс ферментов-изомераз, которые влияют на топологию ДНК.[6] Впервые топоизомеразы были описаны профессором Гарвардского университета Джеймсом Вангом.
Молекулярная масса топоизомераз колеблется в пределах от 60 тыс. до 140 тыс дальтон. После трансляции фермент подвержен модификациям, в частности, фосфорилированию. Минимальный размер олигонуклеотидов, расщепляемых топоизомеразами ≈ 7-8 нуклеотидных остатков.
В обычном состоянии ДНК пребывает в форме двойной спирали, и такая структура не позволяет отдельным цепочкам расходиться. Для расплавления двойной спирали (разрыва водородных связей между основаниями) используются специальные ферменты — хеликазы, которые позволяют осуществлять транскрипцию или репликацию другим белкам.[7]
Классификация ферментов основана на механизме их действия на молекулу ДНК: к топоизомеразам I группы относятся ферменты, катализирующие изменения топологическое состояния молекулы с помощью однонитевого разрыва-зашивания двухнитевой молекулы ДНК, к топоизомеразам II группы — с помощью двухнитевого разрыва-зашивания. В некоторых случаях реакция АТФ-зависимая.
Установлено, что топоизомеразы I группы образуют в ходе реакции ковалентный промежуточный комплекс ДНК-белок. Фермент эукариот соединяется через тирозиновый остаток с 3'-концом разорванной цепи ДНК, у прокариот — с 5'-концом. После перемещении разорванных концов ДНК относительно друг друга обе формы топоизомераз восстанавливают ее целостность.
Встраивание вирусной ДНК в хромосомы хозяина и другие формы рекомбинации также требуют присутствие топоизомераз.[8]
Активность топоизомеразы во многих случаях угнетается противоопухолевыми и противомикробными препаратами (например, налидиксовой и оксолиниевой кислотами).
[59] О. О. Фаворова. Сохранение ДНК в ряду поколений: репликация ДНК.
[60] Анимация: Удвоение ДНК (функции различных белков) (англ.)
Генетический код
[править]В последовательности нуклеотидов ДНК закодирована последовательность аминокислот в белках
[править]Дезоксирибонуклеи́новая кислота́ (ДНК) представляет собой полимерную молекулу сложной структуры длиной от нескольких тысяч пар нуклеотидов (пн) до нескольких миллионов пар нуклеотидов.
- кишечная палочка ~3,8 мпн (~ 1,3 мм)
- дрожжи ~13,5 мпн
- дрозофила ~105 мпн
- человек ~3000 мпн (~ 1 метр), длина всех 23 молекул ДНК гаплоидного набора хромосом)
В ДНК зашифрована информация о первичной структуре белков посредством комбинации нуклеотидов. Процесс «переписывания» этого кода с ДНК в молекулы РНК называется транскрипцией, а синтез белка в рибосомах по матрице иРНК, в ходе которого происходит «перевод» нуклеотидного кода в последовательность аминокислот — трансляцией.
Генетический код ДНК состоит из триплетов, то есть из тройных комбинаций нуклеотидов. При транскрипции генетический код «переписывается» в последовательность нуклеотидов иРНК. Тройки нуклеотидов иРНК, кодирующие аминокислоты, называются кодонами. Из 64 возможных триплетов (4³) 61 являются смысловым кодонами, то есть кодируют аминокислоты. Все кодоны триплетны, неразрывны и не перекрываются в тексте (как считалось по одной из гипотез), а также не разделены межкодонными знаками. Все кодоны однозначны, то есть каждый кодон кодирует единственную аминокислоту.
Генетический код содержит в себе также знаки пунктуации (начала и конца трансляции). Кодоны AUG, GUG и UUG у прокариот помимо кодирования аминокислот кодируют ещё и команду начала трансляции. Однако однозначность генетического кода при этом не нарушается, так как инициирующие знаки располагаются в определенном окружении (контексте), способном образовывать самокомплементарные субъединицы. У эукариот инициирующими триплетами являются AUG, UUG, AUA и ACG. Три кодона из 64 (UGA, UAG, UAA) не кодируют аминокислот, а служат знаками окончания трансляции (стоп-кодоны). Обычно ими заканчиваются все транслируемые гены. Возникновение в результате мутации нонсенс-кодонов внутри гена приводит к преждевременной терминации трансляции и прекращению синтеза белка.
Расшифровке генетического кода помог синтез искусственных РНК
[править]В1953 году Фрэнсис Крик совместно с Джеймсом Уотсоном сделал предположение, что только 20 кодонов генетического кода имеют значение, а остальные 44 триплета являются бессмысленными. В 1961 Ф. Крик с сотрудниками получил подтверждение гипотезы триплетного неперекрывающегося кода без запятых.
Расшифровать генетический код удалось in vitro, благодаря технике белкового синтеза в бесклеточных системах, то есть в клеточных экстрактах, содержащих все необходимые компоненты аппарата трансляции (тРНК, иРНК, рибосомы, аминокислоты, ферменты, источник энергии (АТФ и ГТФ), а также вспомогательные компоненты), за исключением только принадлежащий клетке мРНК. Вводя в такие экстракты искусственно синтезированные мРНК, можно было изучать включения меченых аминокислот в строящиеся белки. М. Ниренберг и Ф. Ледер провели опыт по помещению в бесклеточную систему трансляции различных олигорибонуклеотидов и выявили, что конкретные тририбонуклеотиды, ассоциированные с рибосомами, связывают только определенные фракции тРНК, с определенными мечеными аминокислотами. Например, олигорибонуклеотид УУУ связывает тРНК, имеющую антикодон ААА и несущую аминокислоту фенилаланин. Следовательно, кодон мРНК УУУ кодирует аминокислоту фенилаланин. С помощью такого метода к 1965 году генетический код был расшифрован полностью.
Летом 1966 года на симпозиуме по количественной биологии в Колд-Спринг-Харборе (США) все полученные данные были систематизированы Ф. Криком. Расшифрованный генетический код E. coli, исследованный методом in vitro, полностью согласовывался также с другими независимыми данными, полученными методом in vivo для других видов.
Основные свойства генетического кода одинаковы у всех живых организмов
[править]Генетический код — способ кодирования последовательностью нуклеотидов в ДНК аминокислотной последовательности белков. Для генетического кода характерны следующие свойства (см. следующие разделы):
- Триплетность — каждая аминокислота закодирована триплетом — сочетанием трех соседних нуклеотидов ДНК
- Вырожденность — большинство аминокислот кодируются более чем одним триплетом
- Неперекрываемость — триплеты читаются подряд без перекрывания, начиная с одной стартовой точки
- Непрерывность — в пределах участка, кодирующего одну молекулу белка или РНК, триплеты читаются
подряд, без пропусков
- Однозначность — каждый триплет кодирует только одну аминокислоту или является терминатором трансляции
- Универсальность — все живые существа используют одинаковые наборы кодонов для кодирования одних и тех же аминокислот.
Генные знаки препинания
Участок ДНК, кодирующий одну полипептидную цепь или одну молекулу РНК, называется геном. После каждого кодирующего белок участка гена находится стоп-кодон, регулирующий трансляцию. К таким «знакам препинания» относятся и стоп-кодоны UAA, UAG и UGA.
Эти сигналы опознаёт рибосома, но не РНК_полимераза — для неё на ДНК есть свои «стоп-сигналы», состоящие более чем из трех нуклеотидов.
Кодон AUG (первый после лидерной последовательности) выполняет роль «заглавной буквы», то есть кодирует метионин (у эукариот) или формилметионин (у прокариот), с которого начинается образование полипептидной цепи в процессе трансляции.
Кодоны UAA (охра, или Ochre), UAG (амбер-кодон, или Amber) и UGA (опал, или Opal) являются терминаторными кодонами и кодируют прекращение (терминацию) синтеза полипептиднойцепи трансляции.
Если AUG — «заглавная буква», стоп-кодоны — «точки», то с «абзацем» можно сравнить оперон и комплементарная ему мРНК, присутствующие только в прокариотической клетке. Оперон — участок ДНК бактерии, отвечающий за отдельный участок метаболического пути. Он кодирует совместно или последовательно работающие белки, объединенные под одним (или несколькими) промоторами.
У эукариот внутригенные стоп-кодоны и иные «знаки препинания» отсутствуют, что было экспериментально доказано Сеймуром Бензером и Фрэнсисом Криком в 1961 году. У прокариот с оперона часто считывается одна молекула полицистронной мРНК. В её нуклеотидной последовательности есть несколько стоп-кодонов, а между ними — рамки считывания для нескольких полипептидных цепочек. При трансляции прокариотическая рибосома «перепрыгивает» стоп-кодоны и продолжает синтез следующего белка, а синтезированная полипептидная цепь при этом отделяется от рибосомы.
Генетический код триплетный
[править]У всех живых организмов генетический код триплетный. Это означает. что одна аминокислота кодируется тремя следующими друг за другом нуклеотидами ДНК - триплетом. Три нуклеотида иРНК, кодирующие одну аминокислоту или представляющие собой сигнал остановки синтеза, называются кодоном. Трёхбуквенные "слова" нуклеотидного языка, в котором есть всего четыре буквы - самые короткие, с помощью которых можно закодировать все 20 основных аминокислот. Если составлять нуклеотидные слова из двух букв, то их будет всего 16 - не хватает! Трёхбуквенных слов хватает уже с избытком - их 64. Почти все триплеты (кроме трех, а в некоторых случаях - кроме одного) значащие, поэтому код вырожденный (см. ниже).
Генетический код неперекрывающийся
[править]В 1956 году американский ученый Джордж Гамов высказал предположение о перекрываемости генетического кода. Оно заключается в следующем: предположим, у нас есть следующая последовательность нуклеотидов: УУАГУААЦГУАА
В этой последовательности могут действовать кодоны
УУА ГУА АЦГ УАА ххУ УАГ УАА ЦГУ ААх хУУ АГУ ААЦ ГУА Ахх
Плюс перекрываемого кода — компактность (недаром это свойство обнаружено у некоторых генов вирусов). Минус — явная зависимость структуры белка от замены нуклеотида.
После расшифровки генетического кода было показано, что он неперыкрывающийся, то есть в последовательности нуклеотидов УУАГУААЦГУАА действуют только кодоны УУА ГУА АЦГ УАА.
Как правило, для каждого гена существует одна открытая рамка считывания.
Генетический код непрерывный
[править]До расшифровки генетического кода выдвигалось предположение, что только 20 кодонов - значащие, остальные пропускаются при считывании кода. Однако выяснилось, что значащих кодонов 61, и лишь три кодона (стоп-кодоны) не кодируют аминокислот. При синтезе белка (трансляции) рибосома движется по иРНК, пока не достигает стоп-кодона, считывая все кодоны подряд, без пропусков.
У бактерий многие иРНК полицистронные. Они кодируют несколько полипептидных цепей, и кодирующие их последовательности разделены стоп-кодонами. При трансляции бактериальная рибосома "перескакивает" стоп-кодоны, сразу же начиная синтез следующей полипептидной цепи; белок, синтез которого закончился, при этом отделяется от рибосомы.
Генетический код вырожденный
[править]В 1954 году американский ученый Джордж Гамов высказал предположение о кодировании одним кодоном одной аминокислоты, но это предположение оказалось неверным. Так как триплет состоит из трёх последовательных нуклеотидов, а всего этих нуклеотидов четыре различных, возможных триплетов может быть 4 ³=64 (кроме стоп-кодонов UAA, UAG и UGA, так что не 64, а 61), что превышает количество существующих аминокислот. В связи с этим было высказано предположение, подтвердившееся в дальнейшем, о так называемой вырожденности генетического кода — одну аминокислоту кодирует больше одного триплета, за исключением метионина и триптофана.
Отдельные аминокислоты кодируются группами (сериями) кодонов-синонимов. 18 серий из 20 содержат от двух до шести кодонов, две серии (для аминокислот метионина и триптофана) не вырождены и содержат по одному кодону. Средняя вырожденность генетического кода приблизительно равна трём кодонам на серию.
Вырожденность называется систематической, если синонимичные кодоны различаются либо пуринами, либо пиримидинами, либо вообще любыми из четырех своих нуклеотидов. Этим принципам удовлетворяют только 30 пар кодонов из 32 возможных, а также только восемь тетрад из 16. Остальные же варианты вырожденности называются несистематическими. Они относятся, как правило, к большим сериям: лейцин и аргинин — связные серии, серин — несвязная серия, изолейцин, кодируемый в три кодона — полносвязная серия.
Генетический код однозначный
[править]Единственный известный на сегодняшний день пример, когда это свойство нарушается — использование кодона UGA у инфузории Euplotes crassus. В зависимости от окружения он кодирует две аминокислоты — цистеин и селеноцистеин [61].
Генетический код универсальный
[править]Универсальность генетического кода означает использование всеми живыми организмами одного генетического кода, то есть все живые существа используют одинаковые наборы кодонов для кодирования одних и тех же аминокислот.
Мутации и их последствия
[править]Мута́ция — стойкое (то есть такое, которое может быть унаследовано потомками данной клетки или организма) изменение генотипа. Процесс возникновения мутаций называется мутагенез.
Мутации делятся на спонтанные и индуцированные. Спонтанные мутации возникают самопроизвольно в нормальных для организма условиях окружающей среды с частотой около — на нуклеотид за клеточную генерацию.
Индуцированные мутации возникают в результате тех или иных мутагенных воздействий в искусственных (экспериментальных) условиях или при неблагоприятных воздействиях окружающей среды.
Мутации появляются постоянно в ходе процессов, происходящих в живой клетке. Основные процессы, приводящие к возникновению мутаций — репликация ДНК, нарушения репарация ДНК и генетическая рекомбинация.
Связь мутаций с репликацией ДНК
Многие спонтанные химические изменения нуклеотидов приводят к мутациям, которые возникают при репликации. Например, из-за деаминирования цитозина напротив него в цепь ДНК может включаться урацил (образуется пара У-Г вместо канонической пары Ц-Г). При репликации ДНК напротив урацила в новую цепь включается аденин, образуется пара У-А, а при следующей репликации она заменяется на пару Т-А, то есть происходит транзиция.
Связь мутаций с рекомбинацией ДНК
Из процессов, связанных с рекомбинацией, наиболее часто приводит к мутациям неравный кроссинговер. Он происходит обычно в тех случаях, когда в хромосоме имеется несколько дуплицированных копий исходного гена, сохранивших похожую последовательность нуклеотидов. В результате неравного кроссинговера в одной из рекомбинантных хромосом происходит дупликация, а в другой — делеция.
Связь мутаций с репарацией ДНК
Спонтанные повреждения ДНК встречаются довольно часто, такие события имеют место в каждой клетке. Для устранения последствий подобных повреждений имеется специальные репарационные механизмы (например, ошибочный участок ДНК вырезается и на этом месте восстанавливается исходный). Мутации возникают лишь тогда, когда репарационный механизм по каким-то причинам не работает или не справляется с устранением повреждений. Мутации, возникающие в генах белков, ответственных за репарацию, могут приводить к многократному повышению (мутаторный эффект) или понижению (антимутаторный эффект) частоты мутирования других генов.
Так, мутации генов многих ферментов системы эксцизионной репарации приводят к резкому повышению частоты соматических мутаций у человека, а это, в свою очередь, приводит к развитию пигментной ксеродермы и злокачественных опухолей покровов.
Репарация ДНК
[править]Репарация (от лат. reparatio — восстановление) — особая функция клеток, заключающаяся в способности исправлять химические повреждения и разрывы в молекулах ДНК, повреждённой при нормальном биосинтезе ДНК в клетке или в результате воздействия физических или химических агентов. Осуществляется специальными ферментными системами клетки.
Источники повреждения ДНК
[править]- Ультрафиолетовое излучение
- Радиация
- Химическое соединение|Химические вещества]]
- Ошибки репликации ДНК
- Апуринизация — отщепление азотистых оснований от сахарофосфатного остова
- Дезаминирование — отщепление аминогруппы от азотистого основания
Основные типы повреждения ДНК
[править]- Повреждение одиночных нуклеотидов
- Повреждение пары нуклеотидов
- Разрыв цепи ДНК
- Образование поперечных сшивок между основаниями одной цепи или разных цепей ДНК
Устройство системы репарации
[править]Каждая из систем репарации включает следующие компоненты:
- хеликаза — фермент, «узнающий» химически изменённые участки в цепи и осуществляющий разрыв цепи вблизи от повреждения;
- фермент, удаляющий повреждённый участок;
- ДНК-полимераза — фермент, синтезирующий соответствующий участок цепи ДНК взамен удалённого;
- ДНК-лигаза — фермент, замыкающий последнюю связь в полимерной цепи и тем самым восстанавливающий её непрерывно
Типы репарации
[править]У бактерий имеются по крайней мере 3 ферментные системы, ведущие репарацию — прямая, эксцизионная и пострепликативная. У эукариот к ним добавляется еще mismatch-репарация и Sos-репарация.
Прямая репарация
[править]Прямая репарация — наиболее простой путь устранения повреждений в ДНК, в котором обычно задействованы специфические ферменты, способные быстро (как правило, в одну стадию) устранять соответствующее повреждение, восстанавливая исходную структуру нуклеотидов. Так действует, например, O6-метилгуанин-ДНК-метилтрансфераза, которая снимает метильную группу с азотистого основания на один из собственных остатков цистеина.
Эксцизионная репарация
[править]Эксцизионная репарация (англ. excision — вырезание) включает удаление повреждённых азотистых оснований из ДНК и последующее восстановление нормальной структуры молекулы.
Пострепликативная репарация
[править]Tип репарации, имеющей место в тех случаях, когда процесс эксцизионной репарации недостаточен для полного исправления повреждения: после репликации с образованием ДНК, содержащей поврежденные участки, образуются одноцепочечные бреши, заполняемые в процессе гомологичной рекомбинации при помощи белка RecA.
Пострепликативная репарация была открыта в клетках E.сoli, не способных выщеплять тиминовые димеры. Это единственный тип репарации, не имеющий этапа узнавания повреждения.
Транскрипция и трансляция — основные этапы синтеза белка
[править]Транскрипция — синтез РНК по матрице ДНК. У эукариот транскрипция происходит в ядре, а также в митохондриях и пластидах (как вы помните, у этих органелл есть собственный геном). В ходе транскрипции происходит синтез мРНК, тРНК и рРНК, которые непосредственно задействованы в синтезе белка, а также всех остальных типов РНК клетки (siРНК, piРНК, гидовые РНК, малые ядерные РНК и др.).
Трансляция — процесс синтеза белка на рибосомах, который происходит в цитоплазме клеток, а у эукариот - также в митохондриях и хлоропластах.
Транскрипция — синтез РНК на ДНК
[править]Транскри́пция (от лат. transcriptio — переписывание) — процесс синтеза РНК с использованием ДНК в качестве матрицы, происходящий во всех живых клетках.
Транскрипция катализируется ферментом ДНК-зависимой РНК-полимеразой. Процесс синтеза РНК протекает в направлении от 5'- к 3'- концу, то есть по матричной цепи ДНК РНК-полимераза движется в направлении 3'->5'.
Транскрипция - первый этап экспрессии гена. Если ген кодирует белок, то второй этап его экспрессии - трансляция, синтез белка на рибосомах. Но многие гены не кодируют белков. Это гены рРНК и тРНК, а также множества малых РНК, имеющих регуляторные или ферментативные функции. Такие гены при экспрессии не транслируются, а только транскрибируются; этаопм их экспрессии можно считать созревание (процессинг) РНК.
Транскрипция состоит из стадий инициации, элонгации и терминации.
Транскрипция у прокариот
[править]Особенности транскрипции у эукариот. Процессинг и сплайсинг РНК
[править]Практические все гены эукариот имеют экзон-интронную структуру. Они содержат экзоны (участки, кодирующие белок или РНК) и находящиеся между ними интроны - участки, которые ничего не кодируют. С ДНК при транскрипции считывается первичный транскрипт - РНК, содержащая и экзоны, и интроны. Затем интроны удаляются в ходе сплайсинга.
Сплайсинг - лишь один из этапов процессинга РНК. Процессинг - совокупность процессов в клетках эукариот, которые приводят к превращению первичного транскрипта РНК в зрелую РНК. Например, в ходе процессинга иРНК происходит ее кэпирование и полиаденилирование (см. ниже).

- [62] Анимация «Жизненный цикл мРНК эукариот» (англ. текст)
- [63] Анимация «Сплайсинг мРНК» (англ. ткст)
Роль рРНК, тРНК и иРНК в клетке
[править]
тРНК — небольшие (длиной обычно от 74 до 95 нуклеотидов) молекулы РНК, которые переносят аминокислоты в рибосомы и обеспечивают их включение в состав растущей белковой цепи в ходе трансляции.
Трансляция
[править]Трансляция — осуществляемый рибосомой синтез белка из аминокислот на матрице информационной (или матричной) РНК (иРНК или мРНК). Трансляция может происходить в клетках и в искусственных бесклеточных системах. Чтобы в пробирке с физиологическим раствором могла идти трансляция, туда необходимо добавить:
- рибосомы - "машины" для синтеза белка),
- иРНК - матрицы,
- тРНК - переносчики аминокислоты и "адаптеры", переводящие нуклеотидный код в последовательность аминокислот,
- аминокислоты - строительный материал,
- специальные ферменты аминоацил-тРНК-синтетазы - обеспечивают специфичное присоединение каждой аминокислоты к "своей" тРНК
- молекулы АТФ и ГТФ, гидролиз которых служит источником энергии для синтеза белка.
Кроме этого, для нормального синтеза белка необходим ряд дополнительных белков, не входящих в состав рибосом - факторы инициации, элонгации и терминации.
Рибосомы — машины для синтеза белка
[править]Рибосомы - это немебранные органоиды, отвечающие за синтез белков и содержащиеся во всех клетках, и даже некоторых органоидах, а именно – митохондриях и хлоропластах. Рибосомы состоят из двух субъединиц - большой и малой. Эти субъединицы собираются в ядрышке. Рибосомы можно поделить на две группы: сидячие и свободные. По функциям они принципиально не различаются. Единственное различие в том,что сидячие рибосомы расположены на шероховатой эндоплазматической сети, а свободные находятся в цитоплазме. Нередко рибосомы образуют полирибосомы (полисомы) — цепочки из рибосом, расположенных на нити иРНК.
Особенности рибосом прокариот, эукариот и органоидов
[править]Этапы трансляции
[править]
- [64] — Анимация «Синтез белка. Элонгация» (англ.текст)
Во время процесса транскрипции информация с ДНК копируется на РНК. Информационная РНК (иРНК) становится матрицей для синтеза белка. Транспортная РНК доставляет в рибосому строительный материал для синтеза белка — аминокислоты. После того, как иРНК и аминокислоты попали в рибосому, тРНК переводит генетический код аминокислоты, считывая кодон РНК (т.к. имеет антикодон).А специфичное присоединение аминокислот к соответствующей тРНК обеспечивает особый фермент — аминоацил-тРНК-синтетаза. Энергию для синтеза обеспечивает гидролиз молекул ГТФ. К одной молекуле РНК часто присоединяется множество рибосом, образуя "бусы" из рибосом — полирибосому, или полисому. Рибосомы одна за другой "ползут" по нити иРНК. Когда рибосома достигает стоп-кодона, она распадается на половинки - субъединицы.
Другие типы РНК и их роль в клетке
[править]Центральная догма молекулярной биологии. Передача и реализация наследственной информации
[править]«Это был тот самый дух, который вскоре принес нам „центральную догму“, против чего я выступил, по-моему, первым… Я увидел в этом первые ростки чего-то нового — какой-то нормативной биологии, которая повелевает природе вести себя в соответствии с нашими моделями.» Э. Чаргафф
- [65] — Белковая «наследственность» (прионы)
Регуляция работы гена: лактозный оперон
[править]Строение лактозного оперона
[править]Оперон — функциональная единица генома у прокариот, в состав которой входят гены, кодирующие совместно или последовательно работающие белки и часто объединенные под одним промотором.
Концепцию оперона для прокариот предложили в 1961 году французские ученые Франсуа Жакоб, Жан Моно и Андре Львов, за что получили Нобелевскую премию в 1965 году.
Характерным примером оперонной организации генома прокариот является лактозный оперон. Регуляция экспрессии генов метаболизма лактозы у кишечной палочки (Escherichia coli) была впервые описана в 1961 году учеными Ф. Жакобом и Ж. Моно.
Лактозный оперон (lac оперон) — полицистронный оперон бактерий, в состав которого входят гены, отвечающие за усвоение и расщепление лактозы.
Лактозный оперон состоит из промотора, оператора, трех структурных генов и терминатора. Иногда принимается, что в состав оперона входит также ген-регулятор, который кодирует белок-репрессор.
Промотор — последовательность нуклеотидов ДНК, узнаваемая РНК-полимеразой как стартовая площадка для начала специфической, или осмысленной, транскрипции. У прокариот все промоторы включают ряд похожих последовательностей нуклеотидов, важных для узнавания их РНК-полимеразой; в то же время разные промоторы отличаются друг от друга по другим последовательностям. Промотор асимметричен, что позволяет РНК-полимеразе начать транскрипцию в правильном направлении и указывает то, какая из двух цепей ДНК будет служить матрицей для синтеза РНК. Промотор может частично перекрываться или вовсе не перекрываться с оператором.
Оператор — это последовательность нуклеотидов ДНК, с которой связывается регуляторный белок — репрессор или активатор.
Структурные гены — это гены, кодирующие белки.
Структурные гены лактозного оперона — lacZ, lacY и lacA:
- lacZ кодирует фермент β-галактозидазу, которая расщепляет дисахарид лактозу на глюкозу и галактозу,
- lacY кодирует β-галактозид пермеазу, мембранный транспортный белок, который переносит лактозу внутрь клетки.
- lacA кодирует β-галактозид трансацетилазу, фермент, переносящий ацетилную группу от ацетил-КoA на бета-галактозиды.
Для усвоения лактозы необходимы только продукты генов lacZ и lacY, роль продукта гена lacA не ясна.
При транскрипции с лактозного оперона считывается одна полицистронная мРНК, в которой закодированы все три белка. С неё сразу же начинают считываться эти белки, причем рибосомы «перескакивают» стоп-кодоны, разделяющие нуклеотидные последовательности, кодирующие каждый из белков. (Для прокариот полицистронные РНК обычны, у эукариот они практически не встречаются).
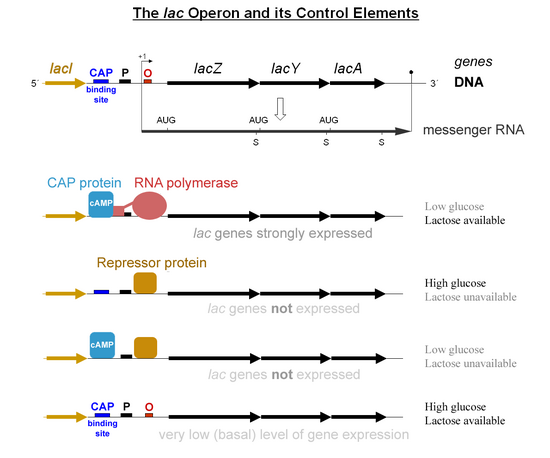
Регуляция работы лактозного оперона
[править]Бактериальная клетка синтезирует ферменты, принимающие участие в метаболизме лактозы, лишь в том случае, когда лактоза присутствует в окружающей среде и клетка испытывает недостаток глюкозы.
РНК-полимераза начинает транскрипцию с промотора, который в случае лактозного оперона перекрывается с оператором. В отсутствие или при низкой концентрации лактозы в клетке белок-репрессор, который является продуктом гена LacI, обратимо соединяется с оператором и препятствует транскрипции. Таким образом, в отсутствие лактозы в клетке ферменты для метаболизма лактозы не синтезируются.
Даже в случае, когда в плазматической мембране клетки отсутствует фермент β-галактозидпермеаза, лактоза из окружающей среды может попадать в клетку в небольших количествах. В клетке две молекулы лактозы связываются с белком-репрессором, что приводит к изменению его конформации и далее к отделению белка-репрессора от оператора. Теперь может осуществляться транскрипция генов лактозного оперона. При снижении концентрации лактозы новые порции белка-репрессора взаимодействуют с операторными последовательностями и препятствуют транскрипции. Данный механизм регуляции активности лактозного оперона называют позитивной индукцией. Веществом-индуктором служит лактоза; при её связывании с белков-репрессором происходит его отделение от оператора.
Если в клетке концентрация глюкозы достаточная для поддержания обмена веществ, активация лактозного оперона не происходит. Промотор лактозного оперона «слабый» — даже при отсутствии белка-репрессора на операторе транскрипция практически не инициируется без дополнительных условий. Когда концентрация глюкозы в клетке снижается, происходит активация фермента аденилатциклазы, которая катализирует превращение АТФ в циклическую форму — цАМФ (цАМФ в данном случае также называют «сигналом клеточного голода»). Глюкоза — ингибитор фермента аденилатциклазы; кроме того, она активирует фосфодиэстеразу — фермент, катализирующий расщепление цАМФ.
цАМФ соединяется с белком, активирующим катаболизм (англ. САР, catabolism activating protein). Образуется комплекс цАМФ-CAP, который взаимодействует с промотором лактозного оперона, изменяет его конформацию и приводит к повышению сродства РНК-полимеразы к данному участку. В присутствии лактозы и при высокой концентрации цАМФ (то есть в отсутствии глюкозы) происходит активная транскрипция генов оперона, активно синтезируются ферменты для усвоения лактозы. Механизм регуляции активности лактозного оперона глюкозой называют негативной индукцией — глюкоза служит «негативным индуктором», то есть веществом, в присутствии которого лактозный оперон «выключен».
Итак, ферменты для усвоения лактозы синтезируются в клетке кишечной палочки при двух условиях: 1) наличие лактозы; 2) отсутствие глюкозы.
- Вопрос 1
- Мутации каких участков в ДНК кишечной палочки могут привести к появлению бактерий:
- Не способных усваивать лактозу?
- Синтезирующих ферменты для усвоения лактозы даже в её отсутствие?
- Способных усваивать лактозу при высокой концентрации глюкозы?
Для простоты будем считать. что любая мутация приводит к «поломке» (выходу из строя) гена или иного участка ДНК.
Биологический смысл
[править]Благодаря описанному механизму регуляции транскрипции генов, входящих в состав лактозного оперона, бактерии оптимизируют энергетические затраты, синтезируя ферменты метаболизма лактозы не постоянно, а лишь тогда, когда клетке это необходимо. Сходный механизм регуляции имеется у большинства прокариот; у эукариот он устроен значительно сложнее.
Регуляция работы лактозного оперона в зависимости от концентрации лактозы происходит по принципу отрицательной обратной связи: чем больше лактозы — тем больше ферментов для её усвоения (положительная прямая связь); чем больше ферментов — тем меньше лактозы, чем меньше лактозы — тем меньше производится ферментов (двойная отрицательная обратная связь).
- [66] Анимация «Регуляция работы лактозного оперона» (англ. текст)
Регуляция работы генов эукариот
[править]У эукариот опероны отсутствуют, и система управления активностью генов более сложная. Во-первых, у эукариот часто одновременно включаются не три гена (или чуть больше), а целые батареи генов. Во-вторых, регуляция активности генов происходит не только за счет связывания белков с промоторами генов, но и за счет взаимодействия с генами энхансеров и сайленсеров, за счет спирализации и деспирализации хромосом и других механизмов. В-третьих, у эукариот регуляция работы генов чаще происходит не по принципу «да–нет», а по принципу «больше–меньше».
В клетках эукариот от ДНК исходят сигналы, которые в конечном счете передаются РНК-полимеразе: стимулируют или подавляют инициацию синтеза РНК. Источником сигналов служат определенные локусы ДНК — регуляторные элементы. Эти участки имеют небольшие размеры, порядка 10 н. п. Регуляторные элементы, стимулирующие транскрипцию, называют энхансерами (англ. enhancer — усилитель), а подавляющие транскрипцию — сайленсерами (англ. silencer — глушитель, успокоитель). Регуляторные элементы могут избирательно соединяться с белками-регуляторами. Белки, соединяющиеся с энхансерами, называют индукторами, а соединяющиеся с сайленсерами — репрессорами. Цис-элементы действуют на гены только той молекулы ДНК, в которой они сами находятся. Энхансеры и сайленсеры могут располагаться вблизи от промотора и от стартовой точки транскрипции регулируемого гена, но могут быть и удалены от него, даже на тысячи нуклеотидных пар, как в сторону 5'-конца, так и в сторону З'-конца. Однако они могут быть сближены в результате изгибания молекулы ДНК. Белки-регуляторы (индукторы и репрессоры) содержат по крайней мере три домена:
- домен, узнающий определенную нуклеотидную последовательность ДНК; ;
- домен, узнающий трансэлементы;
- домен, взаимодействующий с факторами транскрипции в области ТАТА-последовательности; в результате этого белки-регуляторы влияют на транскрипцию, а именно увеличивают (индукторы) или уменьшают (репрессоры) частоту инициации транскрипции.
Каждый ген регулируется независимо от других. Следовательно, для каждого гена существуют специфические регуляторные элементы (локусы ДНК) и специфические регуляторные белки, узнающие эти элементы. Уже известно много регуляторных белков и регуляторных элементов разных генов, и постоянно обнаруживаются все новые и новые. Присоединение регуляторных белков к энхансерам или сайленсерам зависит от других веществ — трансэлементов, сигнальных молекул, приносимых в клетку с кровью или образующихся в самой клетке. К числу таких молекул относятся гормоны, некоторые метаболиты, ионы металлов. Есть регуляторные белки, реагирующие на изменение температуры. Все эти сигналы стимулируют присоединение индукторов к соответствующим энхансерам или репрессоров к соответствующим сайленсерам. Трансэлементами их называют потому, что они могут действовать на любую молекулу ДНК (любую хромосому), если только в ней есть подходящий цис-элемент.
Методы исследования клеток
[править]Световой микроскоп
[править]Принцип работы
[править]Приготовление срезов и окрашивание препаратов
[править]Современные методы световой микроскопии
[править][67] — Использование GFP и других флуоресцентных белков в молекулярной биологии
Электронная микроскопия
[править]Принцип работы
[править]Трансмиссионная и сканирующая электронная микроскопия
[править]Основные биохимические методы
[править]- [68] Анимация «Гель-электрофорез ДНК» (агл.текст)
Основные методы молекулярной биологии
[править]- [69] — Анимация «Клонирование ДНК с помощью плазмид» (англ.текст)
- [70] Анимация «Создание библиотек ДНК» (англ. текст)
- [71] — Анимация «Полимеразная цепная реакция» (англ.текст)
- [72] — Анимация «Технология исследования ДНК с помощью чипов» (англ. текст)
Обмен веществ и превращения энергии в клетках
[править][73] — Курс лекций по биоэнергетике проф. Э. Крофтса (Университет штата Иллинойс, 2000 г) (англ.)
Основные способы питания и получения энергии
[править]Все живые организмы с точки зрения физики — открытые системы. Они обмениваются с окружающей средой веществами, энергией и информацией.
Внешние источники энергии нужны живым системам, чтобы
- получать из внешней среды и использовать вещества для роста и размножения,
- двигаться, выбирая лучшие условия для жизни,
- поддерживать высокую упорядоченность (например, синтезировать сложные веществ из простых и доставлять определенные вещества в разные части клеток, создавая из сложную структуру).
При любых процессах превращения энергии, которые происходят в живых системах (и в неживых тоже!) часть энергии рассеивается в виде тепла, и её невозможно повторно использовать для совершения полезной работы. «Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии) — одна из формулировок второго начала термодинамики — в применении к живым системам означает. что без притока энергии извне невозможно поддерживать сложную структуру. Поэтому все живые системы относятся к диссипативным.
Внешние источники веществ нужны, так как в ходе обмена веществ образуются ядовитые «осколки» молекул. Например, при превращении аминокислот в глюкозу выделяется ядовитый аммиак — NH3. Эти вещества выводятся из организма, а новые атомы азота должны поступать с пищей. На выведение ядовитых отходов расходуется вода, в которой они растворяются, так что её запасы тоже приходится восполнять. Наконец, часть органики используется организмами для получения энергии в ходе гликолиза, клеточного дыхания и других процессов. При этом органические молекулы расщепляются, и конечными продуктами могут быть такие вещества, как углекислый газ или водород, которые также выводятся и которые данный организм не может использовать для повторного синтеза органических веществ.
Способы питания и получения энергии живыми организмами, как и все биологические явления и процессы, можно классифицировать по-разному.
Первая классификация основана на том, какой внешний источник энергии использует живой организм. Таких источников для основных процессов жизнедеятельности всего два - свет и энергия химических связей молекул. Если организм использует в качестве источника энергии свет, то это фототроф. Если же источник энергии для организма - энергия химических связей (не важно. органических или неорганических молекул) - это хемотроф.
Связь обмена веществ и энергии в клетках. Катаболизм и анаболизм
[править]АТФ и мембранный потенциал — универсальные источники энергии
[править]Гликолиз — универсальный способ получения энергии
[править]Брожение и гликолиз. История изучения брожения
[править]Гликолиз как пример метаболического пути
[править]Дыхание. Строение и функции митохондрий
[править]Клеточное дыхание, его распространенность среди живых организмов
[править]Строение митохондрий
[править]Митохондрии — округлые или цилиндрические тельца диаметром 1-2 микрометра, окруженные двумя мембранами. Во внутреннюю мембрану заключено содержимое митохондрии — матрикс. Матрикс содержит генетический материал митохондрий (кольцевые, реже линейные молекулы ДНК), рибосомы и другие компоненты системы синтеза белка, ферменты, участвующие в цикле Кребса). Внутренняя мембрана митохондрий образует впячивания — кристы. Во внутреннюю мембрану встроены белки цепи переноса электронов, а также протонная АТФ-синтетаза.
Митохондрии разных эукариот сильно различаются по размерам и числу в клетке, форме крист, количеству и структуре молекул ДНК и другим признакам.
[74] Ченцов Ю. С. Хондриом — совокупность митохондрий клетки. СОЖ, 1997, N 12, с. 10-16
Теория симбиогенеза: происхождение митохондрий
[править]Гипотеза симбиотического происхождения хлоропластов впервые появилась в 1883 году. Её предложил Андреас Шимпер. Достаточно подробно в 1910-е годы теорию симбиогенеза обосновал К.С. Мережковский. В 1920-е годы теория симбиогенеза была развита Б.М. Козо-Полянским, был предложен вариант симбиотического происхождения митохондрий. Активное развитие теории началось уже в работе Линн Маргулис с 1960 года.
Согласно теории симбиогенеза митохондрии произошли от бактерий-симбионтов. Древние протоэукариоты не могли использовать кислород для генерации энергии, поэтому они вступили в симбиотическую связь с будущими митохондриями, захватив их в результате фагоцитоза. В результате эволюции они больше не могут существовать без клеток.
http://biotriton.narod.ru/text/fagocitoz.gif - Анимация фагоцитоза
Митохондрии обладают признаками бактерий:
1. У них имеется 2 замкнутые мембраны, унаследованные от их предков - грамотрицательных бактерий.
2. Размножаются бинарным делением, и только делением.
3. Есть кольцевая ДНК.
4. Имеют рибосомы прокариотического типа для синтеза белков.
То же самое можно сказать и о пластидах.
Основные процессы, происходящие в митохондриях. Цикл Кребса и электронтранспортная цепь
[править]Основные процессы, происходящие в митохондриях. Строение и работа АТФ-синтетазы
[править]
Созданный протонный градиент использует для синтеза АТФ белок со сложной четвертичной структурой - протонная АТФ-синтетаза. Этот белок состоит из закрепленного во внутренней мембране митохондрии статора и вращающегося ротора. При одном обороте ротор пропускает через себя с наружной стороны мембраны на внутреннюю, в матрикс, около десятка протонов через специальный канал. За счет энергии, которая при этом расходуется, меняется конформация трех субъединиц ротора, где происходит синтез трех молекул АТФ из АДФ и фосфорной кислоты.При этом электрическая энергия протонного градиента преобразуется сначала в механическую, а затем - в энергию химических связей АТФ. КПД этого процесса приближается к 100% - больше, чем у любых созданных человеком устройств, преобразующих энергию.
[75]Тихонов А. Н. Молекулярные моторы. Часть 1. Вращающиеся моторы живой клетки // СОЖ. 1999, № 6, с. 8-16
[76]- Лекция «Молекулярные машины» (ФМБФ физтеха; в начале лекции речь идет о наследовании групп крови, а затем про АТФ-синтазу)
[77] — Анимация и видео (текст на английском)
Фотосинтез, его роль в клетке и в биосфере
[править]Варианты фотосинтеза у прокариот
[править]Строение и функции хлоропластов
[править]Теория симбиогенеза: происхождение хлоропластов
[править]Хлоропласты клетки, как и митохондрии - потомки бактерий.
Предками хлоропластов красных и зеленых водорослей, а также глаукофитовых водорослей были цианобактерии. Цианобактерии относятся к грам-отрицательным бактериям (как и предки митохондрий), и пластиды унаследовали от них обе мембраны - плазматическую и наружную. У хоропластов глаукофитовых между ними сохранилась рудиментарная клеточная стенка (их пластиды называют цианеллами, подчеркивая сходство с цинобактериями; однако по размеру генома они похожи на "обычные" пластиды). Такие пластиды, окруженные двумя мембранами, называют первичными.
Пластиды остальных групп водорослей (бурых, диатомовых, эвгленовых, криптофитовых, динофлагеллят и др.) возникли в результате вторичного эндосимбиоза - поглощения эукариотических водорослей бесцветными фаготрофными протистами. Многие из таких вторичных пластид окружены не двумя, а тремя или четырьмя мембранами.
Patrick J. Keeling. The endosymbiotic origin, diversification and fate of plastids. Phil. Trans. R. Soc. B 2010 365, 729-748[78]
Основные процессы, происходящие в хлоропластах: световые стадии
[править]Основные процессы, происходящие в хлоропластах: темновые стадии
[править]Жизненный цикл и функциональные перестройки пластид
[править]Строение и функции плазматической мембраны
[править]Наружная мембрана клеток (плазматическая мембрана, плазмалемма) — обязательный компонент любой клетки. Она состоит из двух слоёв молекул фосфолипидов (см. Фосфолипиды), обязательно содержит белки и может содержать другие вещества (например, в состав плазмалеммы животных клеток входит холестерин). Сходное строение имеют и мембраны органелл клетки.
Фосфолипиды амфифильны и самопроизвольно образуют бислои при взаимодействии с водой
[править]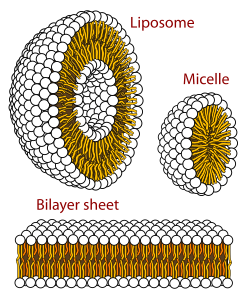
Так как молекулы фосфолипидов амфифильны, их гидрофильные «головы» притягивают к себе диполи воды, а гидрофобные «хвосты» «стремятся» избежать взаимодействия с водой. Если растворить фосфолипиды в эфире или ацетоне и вылить раствор на поверхность воды, то при определенных условиях формируется слой толщиной всего в одну молекулу. В этом слое все «головы» фосфолипидов погружены в воду, а «хвосты» торчат из воды. Если перемешать фосфолипиды с водой (например, встряхиванием или действуя ультразвуком), то истинный раствор (в котором молекулы плавают поодиночке) не возникнет. В толще воды формируются разные структуры из фосфолипидов, в том числе мицеллы и липосомы.
Молекулы мыла, в которых присутствует один остаток жирной кислоты, более склонны к образованию мицелл (см. рис.). Молекулы фосфолипидов чаще образуют липосомы, стенка которых состоит из двойного слоя молекул. В таком липидном бислое гидрофобные "хвосты" с двух сторон заэкранированы "головами" и не контактируют с водой.
Те же силы гидрофильно-гидрофобных взаимодействий делают липидные бислои самозамыкающимися. Любое отверстие в слое создает свободные края, а там гидрофобные хвосты соприкасаются с водой. Это энергетически невыгодно, и молекулы бислоя спонтанно перегруппировываются так, что края исчезают. Если отверстие небольшое, то оно в результате замыкается. Если же отверстие велико, то слой может разделиться на несколько замкнутых пузырьков. В обоих случаях свободные края удаляются.
Липидный бислой — основа биологических мембран
[править]Основой всех биологических мембран, кроме мембран клеток архей, служит фосфолипидный бислой.
У архей мембрана состоит из бислоя или монослоя фосфолипидов, представляющих собой эфиры глицерина и изопреноидных спиртов (алкилов) с разветвленными цепями, а иногда и с циклопропановыми или циклогексановыми кольцами. Изопреноиды имеют длину 20 (в случае бислоя) или 40 (в случае монослоя) атомов. У фосфолипидов однослойных мембран архей (таких, как показанный на рис.слева внизу диалкилглицерол-тетраэфир) две гидрофильные головки.
Фосфолипиды, входящие в состав мембран, у эукариот довольно разнообразны; роль их разнообразия не до конца ясна. В состав мембран эукариотических клеток входит холестерин.
Задача1. Известно, что эритроциты человека практически лишены внутренних мембран. Зная размеры и форму эритроцитов, можно определить их площадь поверхности. Допустим, что общая площадь поверхности эритроцитов из 1 мм³ крови составляет около 250 мм² (попробуйте оценить, насколько правдоподобно это число). Можно разрушить эритроциты, растворить их мембраны в ацетоне и вылить раствор на поверхность воды. При определенных условиях фосфолипиды образуют слой толщиной в одну молекулу. Какова будет площадь этого слоя? Каковы возможные ошибки этой оценки?
Липидный бислой - двумерная жидкость
[править]Молекулы фосфолипидов самопроизвольно (без участия ферментов) очень редко перемещаются из одного слоя мембраны в другой. Поэтому наружный и внутренний слои могут отличаться по составу фосфолипидов. Однако в пределах «своего» слоя в определённом диапазоне температуры молекулы фосфолипидов двигаются примерно с такой же скоростью, что и в жидкости. Образно говоря, мембрана — «двумерная жидкость». Отдельная молекула фосфолипида в этой жидкости перемещается за секунду в среднем на расстояние около 2 мкм. Так что на картинке вверху движение молекул фосфолипидов не такое, как в жизни. Зато на картинке видно, что эти молекулы время от времени слегка «выпирают» из слоя, а между ними образуются небольшие щели. Так и происходит на самом деле.
Течучесть мембран обеспечивает самозамыкание (о его причинах - см. выше). Если воткнуть в клетку тонкую иглу или трубку (микропипетку), а затем вытащить её обратно, то во многих случаях клетка остается целой и невредимой. Образовавшееся в мембране отверстие затягивается, как пленка нефти на поверхности воды, и содержимое клетки не успевает вытечь наружу.
Задача. Как Вы думаете, почему текучесть мембраны важна для ее функционирования? Какие функции мембраны нарушились бы при резком уменьшении текучести?
Текучесть мембраны падает при понижении температуры. При определенной температуре текучесть зависит от состава мембраны. Чем теснее упакованы "хвосты" фосфолипидов, тем менее текучей будет мембрана. Главные свойства углеводородных хвостов, влияющие на плотность упаковки – их длина и количество в них двойных связей.
При увеличении длины "хвостов" (она варьирует от 14 до 24 атомов углерода) текучесть мембраны понижается. Двойные связи в остатках ненасыщенных жирных кислот создают изгибы "хвостов", снижают плотность упаковки и повышают текучесть мембраны.
Задача. В каком масле больше ненасыщенных жирных кислот - сливочном или подсолнечном? Ответ обоснуйте.
У бактерий, грибов и растений при повышении температуры синтезируются фосфолипиды с более длинными "хвостами" и/или меньшим числом двойных связей, чтобы поддерживать текучесть мембран на постоянном уровне.
У животных на текучесть мембран сильнее влияет содержание холестерина. При высокой (35-400С) температуре он снижает текучесть. При низкой температуре он препятствует "замерзанию" мембраны, способствует сохранению подвижности молекул фосфолипидов. Особенно много холестерина в наружной мембране (до 50%, то есть по одной молекуле холестерина на каждую молекулу фосфолипидов).
Вопреки распространенному мнению, стеролы (к которым относится и холестерин) присутствуют и в мембранах клеток некоторых прокариот. Наиболее полный путь биосинтеза стеролов найден у миксобактерий. Правда, нельзя исключить, что часть генов, необходимых для синтеза стеролов, они получили от эукариот путем горизонтального переноса [79]
Липидный бислой гибок. но нерастяжим
[править]Липидный бислой обладает избирательной проницаемостью
[править]Новые фосфолипиды синтезируются на мембранах ЭПС и доставляются в другие мембраны двумя способами
[править]Липосомы — искусственные бислойные структуры, используемые в практике
[править]Жидкие свойства мембран можно изучать, используя искусственные липидные бислои. Часто в опытах используют замкнутые сферические пузырьки – липосомы. Они образуются, если в воду помещают чистые фосфолипиды; их диаметр варьирует от 25 нм до нескольких микрометров (чаще - 25-250 нм).
[80]Барсуков Л. И. Липосомы — Соросовский образовательный журнал, 1998
Основные функции наружной мембраны
[править]- Отграничительная функция. Наружная мембрана обеспечивает целостность клетки, не давая её содержимому (растворимым веществам цитоплазмы) смешаться с окружающей средой или межклеточной жидкостью.
- Транспортная функция. Важное свойство мембраны, связанное с выполнением этой функции — избирательная проницаемость. Некоторые вещества свободно проходят через липидный бислой за счет диффузии, для других он практически непроницаем. За транспорт таких веществ в клетки и из клеток отвечают особые транспортные белки.
- Рецепторная функция. Белки-рецепторы, имеющиеся на наружной мембране любой клетки, обеспечивают восприятие сигналов из внешней среды, их передачу в клетку и запуск ответной реакции. Самый распротсраненный вид сигналов — химические вещества, которые связываются с рецепторами.
- Образование межклеточных контактов.
Белки — обязательный компонент биологических мембран. Типы мембранных белков
[править]Для многих веществ, которые необходимы клетке для роста и получения энергии, липидный бислой практически непроницаем. Так, очень медленно диффундируют через него глюкоза и другие моносахариды, аминокислоты и нуклеотиды.
Уже из этого ясно, что в мембране должны существовать «поры» для транспорта веществ в клетку и из клетки. Транспорт веществ, которые медленно проходят через липидный бислой, осуществляют транспортные белки. Две их основные разновидности - это белки-каналы и белки-переносчики.
Рецепторную функцию мембраны тоже обеспечивают белки. Это - белки-рецепторы. (Часто в состав мембранных рецепторов входят олигосахарадиные цепи, так что, строго говоря, это гликопротеиды). При этом часть рецепторов одновременно служат и ионными каналами. Это, прежде всего, рецепторы нейромедиаторов. Другие рецепторы являются ферментами - они либо активируют специальные белки-посредники (G-белки), либо "работают" протеинкиназами.
Другие компоненты мембран, их роль
[править]В состав клеточных мембран всегда входят белки, а в составе большинства мембран присутствуют также углеводы (точнее, гликолипиды и гликопротеиды). В состав клеточных мембран животных входит холестерин.
Отграничительная функция. Слияние и разделение клеток
[править]Наружная мембрана обеспечивает целостность клетки, не давая её содержимому (растворимым веществам цитоплазмы) смешаться с окружающей средой или межклеточной жидкостью. Только самые мелкие из органических молекул клетки с заметной скоростью «теряются», проходя сквозь липидный бислой.
Замечательная особенность мембраны, связанная с выполнением этой функции — её текучесть. Мембрана представляет собой «двухмерную жидкость» — молекулы фосфолипидов быстро (как в жидкости) диффундируют в плоскости «своего» слоя мембраны. Поэтому мембрана способна к самозамыканию. Если проткнуть мембрану сравнительно тонкой иглой или трубочкой, а потом вынуть её, во многих случаях клетка останется целой — мембрана сомкнётся и «залечит» отверстие.
Транспортная функция. Транспорт веществ через мембрану, его типы
[править]- [81] — Анимация «Унипорт, симпорт, антипорт» (англ. текст)
Тепловое движение молекул — одно из основных свойств материи
[править]
Теплово́е движе́ние' — процесс хаотического (беспорядочного) движения частиц, образующих вещество. Чаще всего рассматривается тепловое движение атомов и молекул.
Хаотичность — важнейшая черта теплового движения. Важнейшими доказательствами существования движения молекул является броуновское движение и диффузия.
Пассивный транспорт не требует затрат энергии
[править]Пассивный транспорт — транспорт, не требующий затрат энергии. Он всегда идет по градиенту концентрации — оттуда, где вещества больше, туда, где его меньше. При этом вещества могут диффундировать через липидный бислой (простая диффузия) или проходить через специальные каналообразующие белки (облегченная диффузия). Иногда пассивный транспорт происходит при участии белков-переносчиков.
Через липидный бислой путем пассивного транспорта проходят малые неполярные молекулы (кислород, углекислый газ, азот, бензол) и полярные молекулы массой до 100 дальтон (глицерин, этанол и др.). ВОда обычно также проходит в клетки и из клеток чеез липдных бислой; в особых случаях, когда транспорт воды нужно резко ускорить, она рпоходит через особые канальные белки - аквапорины.
У человека аквапорины экпрессируются многими клетками - прежде всего, клетками почечных канальцев и эритроцитами. Мутации генов аквапоринов приводят к некоторым наседственным болезням - например. могу вызывать наследственную катаракут и наследственный несахарный диабет. Аквапорины и родственные белки - акваглицеропорины - есть также у растений, грибов, протистов и бактерий. Через акваглицеропорины могут проходить глицерин, мочевина, а также (у растений) ортоборная и ортокрмниевая ислоты и похожие на них соединения.

Осмос - диффузия растворенных веществ
[править]Частный случай пассивного транспорта —- осмос. Обычно осмосом называют диффузию растворителя через преграду, непроницаемую для растворенных веществ. Такие преграды — это обычно тонкие пленки (например, пленки из целлофана, в которые упаковывают многие сорта сосисок). Типичная полупроницаемая пленка — липидный бислой биологических мембран.
Белки-каналы, их строение и функции
[править]Белки-каналы - порообразующие белки, пронизывающие клеточные мембраны. Они имеют сложную третичную, а часто и четвертичную структуру (многие каналы состоят из 2-6 полипептидных цепей). В центре канала находится водная пора. Самое узкое место поры (селективный фильтр) по диаметру лишь немного превышает диаметр атома. У многих каналов есть "ворота" - участки молекулы, которые могут менять конформацию и закрывать пору. У таких каналов есть как минимум два состояния - открытое и закрытое. Наконец. у части каналов есть дополнительный участок (домен), часто похожий по форме на шарик на подвижной проволочке. который может закрывать канал при определенных условиях, делая его нечуствительным к воздействиям. обычно открывающим канал. Такое состояние канала называется инактивированным.
Большинство каналов пропускает определенные ионы. Некоторые каналы пропускают все ионы одного знака заряда (катионы или анионы. Многие каналы пропускают преимущественно одну разновидность ионов. На мембране большинства клеток есть каналы для ионов натрия, калия, хлора и кальция. Многие натриевые каналы непроницаемы для ионов калия. Это неудивительно, так как ионы калия имеют больший диаметр. Но и многие калиевые каналы непроницаемы для ионов натрия! Лишь недавно удалось понять, как обеспечивается такая избирательность.
Два основных типа каналов - лиганд-зависимые и потенциал-зависимые. Лиганд-зависимые каналы открываются при присоединении к ним извне какого-либо вещества (лиганда). Этим они похожи на белки-рецепторы (такие каналы - то же самое, что ионотропные рецепторы). Потенциал-зависимые каналы открываются или закрываются в зависимости от разности потенциала на мембране клетки.
Существуют и другие типы каналов. Например, многие каналы открываются при воздействии на них циклических нуклеотидов (цАМФ или цГМФ)не извне, а из цитоплазмы, с внутренней стороны мембраны. Есть механочувствительные каналы. Некоторые из них открываются при растяжении мембраны. В других случаях канал при натяжении открывает присоединенный к нему элемент цитоскелета или внеклеточного матрикса (так, например, открываются и закрываются натриевые каналы на волосковых клетках внутреннего уха позвоночных.
[82] Схема и описание прохождения ионов калия через калиевый канал (англ.)
Белки-переносчики
[править]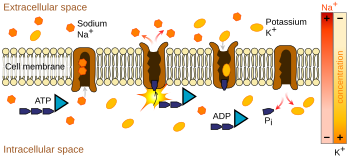
Белки-переносчики — это ещё одна группа транспортных белков. Они участвуют в транспорте веществ, которые не могут пройти сквозь липидный бислой. Белки-переносчики связываются с ионами или молекулами того вещества, которое они переносят, и доставляют их в клетку или из клетки.
От белков–каналов они отличаются тем, что белки-канала - порообразующие белки, они пропускают вещества сквозь заполненную водой пору, а не захватывают и не перетаскивают их на другую сторону мембраны.
Чтобы лучше понять принцип работы белков-переносчиков, рассмотрим работу натрий-калиевой АТФазы.
Натрий-калиевая АТФаза присутствует на мембране почти всех клеток человека. Она действует как насос, перекачивая ионы Na+ из клетки во внешнюю среду, а ионы К+ в клетку. Na+/K+ АТФаза отвечает за поддержание мембранного потенциала клетки.
Как же происходит перенос ионов Na+ и K+? Сначала к натрий-калиевой АТФазе присоединяются три иона Na+, из-за чего изменяется конформация АТФазы. Затем АТФаза расщепляет молекулу АТФ на АДФ и фосфат (РО-³4).
При этом фосфат-ион присоединяется к поверхности белка. Энергия, выделившаяся за счёт расщепления АТФ, расходуется на изменение конформации АТФазы. После всех превращений белок „переворачивается“, и три иона Na+ оказываются на внешней стороне мембраны, а фосфат заменяется на два иона K+, при этом ионы K+присоединяются не к тому месту, где были ионы Na+ , а связываются со своим определённым участком. Из-за этого АТФаза вновь меняет свою конформацию, и ионы К+ переносятся на внутреннюю сторону мембраны. Здесь ионы К+ отсоединяются от АТФазы.
Кроме натрий-калиевой АТФазы есть также кальциевая АТФаза, хлорная АТФаза и другие. Важная особенность белков-насосов заключается в том, что каждый ион движется из области низкой концентрации в область высокой, то есть каждый ион перемещается против своего градиента концентрации. Это движение называется активным транспортом и может происходить только при помощи расходования АТФ.
Помимо активного транспорта белки-переносчики могут осуществлять пассивный транспорт, перемещая вещества из области высокой концентрации в область низкой. Также этот транспорт называют облегчённой диффузией. Например, поступление глюкозы в эритроциты происходит при помощи облегчённой диффузии.
Работа натрий-калиевой АТФазы (на русском языке)
Активный транспорт. Примеры и роль активного транспорта
[править]Активный транспорт обычно обеспечивается белками-переносчиками, которые обладают АТФ-азной активностью.
[83]- Описание строения и работы и анимация натрий-калиевой АТФ-азы (англ.)
Рецепторная функция. Типы белков-рецепторов
[править]У любых клеток есть мембранные белки-рецепторы. Это трансмембранные белки, пересекающие липидный бислой один или несколько раз. В состав многих из них входят олигосахариды (такие рецепторы правильнее называть гликопротеидами).
Такие белки присутствуют не только на наружной мембране, но и на многих внутриклеточных мембранах. Например, рианодиновые рецепторы и рецепторы инозитолтрифосфата есть на мембране эндоплазматического ретикулума.
Мембранные рецепторы связывают сигнальное вещество (лиганд) и при этом изменяют свою конформацию. Часть из них одновременно являются ионными каналами; при связывании лиганда канал может открываться или закрываться. Такие белки называются ионотропные рецепторы. Другие рецепторы при связывании лиганда запускают какую-нибудь химическую реакцию на внутренней стороне мембраны (так что они являются одновременно ферментами или регуляторными белками); такие белки называются метаботропные рецепторы.
Два главных типа метаботропных рецепторов - это рецепторы, сопряженные с G-белками , и рецепторы с протеинкиназной активностью .
Рецепторы, сопряженные с G-белками - это семиспиральные (семь раз пересекающие мембрану в виде альфа-спиралей) белки. Рассмотрим механизм их действия на примере бета-2 адренорецепторов. Это - один из типов адренорецепторов, чувствительный в основном к андреналину (норадреналин действует на них в меньшей степени).

При действии адреналина на эти рецепторы гладкие мышцы бронхов и кровеносных сосудов скелетных мышц расслабляются, а в клетках печени усиливается распад гликогена (гликогенолиз), и образующаяся глюкоза выходит в кровь. С данным типом рецепторов связан Gs-белок. Этот белок, как и другие G-белки, состоит из трех субъединиц (полипептидных цепей) - α,β, и γ. Он "приделан" к внутренней стороне мембраны с помощью двух хвостов жирных кислот и свободно передвигается в плоскости мембраны. С α-субъединицей неактивного Gs-белка связана молекула ГДФ. Когда на бета-2 рецептор действует адреналин, рецептор активируется (меняет свою конформацию) и активирует Gs-белок. В результате α-субъединица отделяется от βγ-субъединицы и обменивает молекулу ГДФ на молекулу ГТФ. Такая активная α-субъединица соединяется с трансмембранным белком-ферментом аденилатциклазой, активируя его.

Этот фермент осуществляет синтез циклического аденозинмонофосфата (цАМФ) из АТФ. цАМФ - один из универсальных вторичных посредников, используемых для передачи сигнала в клетках. В данном случае цАМФ активирует одну из протеинкиназ - протеинкиназу А (РКА). Этот фермент состоит из четырех субъединиц - двух регуляторных и двух каталитических. При связывании четырех молекул цАМФ регуляторные субъединицы отделяются от каталитических, которые при этом активируются. В клетках печени РКА фосфорилирует другую протеинкиназу - киназу фосфорилазы. Киназа фосфорилазы, в свою очередь, фосфорилирует фосфорилазу гликогена. Под действием фосфорилазы происходит фосфоролиз гликогена [84]. В результате образуется глюкоза,которая через белки-переносчики выходит из клеток печени в кровь и потребляется активно работающими при стрессе органами - в первую очередь скелетными мышцами.

Зачем же нужна такая сложная и многоступенчатая система передачи сигнала? Во-первых, на первых этапах сигнал передается с внешней стороны мембраны (на которую действует гормон) на внутреннюю, где происходит синтез цАМФ. Хорошо растворимая, гидрофильная молекула цАМФ быстро диффундирует по всей клетке и передает сигнал во все ее участки. Во-вторых, на каждом этапе сигнализацию можно регулировать. Но главный смысл многоступенчатой передачи - в том, что на большинстве этапов происходит усиление сигнала. Так, за время активности рецептора он может активировать множество молекул G-белка. Каждый Gs-белок активирует одну молекулу аденилатциклазы, но аденилатциклаза синтезирует тысячи молекул цАМФ. 4 молекулы цАМФ активируют всего две каталитических субъединицы РКА, но те могут фосфорилировать множество молекул киназы фосфорилазы, и т.п. В результате такой системы многократного усиления под действием одной молекулы адреналина в клетке печени образуется около 10.000.000 молекул глюкозы.
Когда стресс прошел, уровень секреции адреналина снижается. Из крови адреналин быстро выводится через почки и перестает действовать на рецепторы. После этого инактивируется Gs-белок. G-белки обладают ГТФ-азной активностью: α-субъединица расщепляет связанную с ней молекулу ГТФ до ГДФ (и фосфата), после чего связывается с βγ-субъединицей и переходит в неактивное состояние. таким образом, G-белок действует как автоматический "молекулярный выключатель". Уровень цАМФ в клетке понимается до исходного за счет того, что цАМФ расщепляет особый фермент - фосфодиэстераза. В результате каталитические субъединицы РКА объединяются с регуляторными и инактивируются. Инактивацию киназы фосфорилазы и фосфорилазы гликогена осуществляют ферменты протеинфосфатазы, отщепляющие от этих ферментов фосфатные группы. Так распад гликогена прекращается.
Электрические свойства мембраны. Генерация и проведение нервных импульсов
[править]Потенциал покоя
[править]Разность зарядов достигается за счёт разности концентраций ионов внутри и снаружи клетки. Внутри концентрация ионов калия высокая, а натрия - низкая, а снаружи - наоборот. Эта разность достигается за счёт работы Натрий-Калиевой АТФазы. В состоянии покоя нейрона калиевые каналы открыты, а натриевые закрыты. Катионы калия выходят в зону меньшей концентрации (из клетки) и создают избыточный положительный заряд снаружи клетки.
Таблица по пособию А.А.Мартьянова и О.С.Тарасовой: (Содержание ионов в Нейроне)
| Внутри клетки | Во внешней среде | |
|---|---|---|
| Ионы натрия | 50 ммоль/литр | 440 ммоль/литр |
| Ионы калия | 400 ммоль/литр | 20 ммоль/литр |
Разность зарядов мембраны в состоянии покоя называется потенциалом покоя, а разность зарядов при любом состоянии аксона называется мембранным потенциалом. Когда мембранный потенциал (МП) клетки равен потенциалу покоя(ПП), натриевые каналы закрыты.
Потенциал действия. Генерация нервного импульса
[править]Электрические свойства мембраны нейронов и других возбудимых клеток (например, мышечных) позволяют этим клеткам генерировать и передавать потенциалы действия (если их генерируют нейроны, то они называются также нервные импульсы). Потенциалы действия обычно возикают на дендритах или на теле нейрона, а затем передаются по аксону. Ключевую роль в генерации и передаче нервных импульсов играют свойства каналов наружной мембраны клетки.
Как только МП станет достаточно отличаться от ПП, т.е. изменится до нужной величины - порога, происходит возбуждение. Здесь действует принцип "всё или ничего": если раздражающий фактор не способен изменить МП до порога, то возбуждения нет, а если способен, то возбуждение происходит. При возбуждении нейрона открываются натриевые каналы, и ионы натрия устремляются внутрь клетки, уменьшая отрицательный заряд внутренней стороны мембраны. Это уменьшение мембранного потенциала называется деполяризацией. Ионы натрия будут входить в клетку, пока внутренняя сторона мембраны не станет положительно заряженной относительно внешней стороны. Мембрана перезарядится (+ станет внутри, а - снаружи) После перезарядки мембраны натриевые каналы закрываются, и данный участок аксона определённое время не может возбуждаться. Этот период называется рефрактерностью. После закрытия натриевых каналов, ионы Калия устремляются наружу, уменьшая отрицательный заряд наружной стороны мембраны, пока внешняя сторона не станет положительно заряжена относительно внутренней. Мембрана перезарядится до исходного состояния. Этот этап называется реполяризацией. Все изменения мембранного потенциала от деполяризации до реполяризации называется потенциалом действия, или нервным импульсом. Схема движения нервного импульса по аксону:
+ и - - заряды мембраны
А- Внутренняя среда клетки
Б- Мембрана
В- Внешняя среда
Г- Направление движения Нервного импульса
Д- Возбуждённый участок
Нервный импульс может двигаться только вперёд, так как все задние участки аксона находятся в состоянии рефрактерности. На каждом участке нейрона нервный импульс возникает заново. На рисунке показана схема движения импульса без использования миелиновых оболочек . Скорость движения такого импульса достаточно невелика - приблизительно 3 м/сек. Для ускорения импульса используются w:глиальные клетки, и скорость импульса приблизительно равна 100 м/сек. Глиальные клетки окружают аксон по всей его длине и образуют оболочки - электроизоляторы - миелиновые оболочки, но оставляют небольшие участки нейрона - перехваты Ранье - открытыми. В центральной нервной системе миелиновую оболочку образуют олигодендроциты, а в периферической – леммоциты. Миелиновая оболочка образуется из отростка тела глиальной клетки, лишенного цитоплазмы. Многократно обмотанного вокруг аксона, то есть миелиновая оболочка состоит из многочисленных слоёв мембраны глиальной клетки.
Нервный импульс не может двигаться по участкам, покрытыми миелиновыми оболочками, поэтому нервному импульсу приходится "перепрыгивать" от одного перехвата Ранье к другому.
Далее нервный импульс достигает синапса и вызывает открытие кальциевых каналов. Ионы кальция входят внутрь клетки, и это приводит к слиянию пузырьков с нейромедиаторами с пресинаптической мембранной. Нейромедиаторы попадают в синаптичскую щель, и воздействуют на белки – рецепторы постсинаптической мембраны.
Видео на Английском языке:
Образование межклеточных контактов, их типы
[править]Плотные контакты
[править]
Плотные, или замыкающие контакты (zonula occludens) — участки, на которых мембраны двух соседних (эпителиальных) клеток тесно сближены и образуют барьер, практически непроницаемый для растворенных веществ. У беспозвоночных типичные замыкающие контакты не встречаются, им соответствуют по функциям септированные контакты.
Плотные контакты — система ветвящихся полосок. Каждая полоска состоит из белков, пронизывающих мембраны соседних клеток и непосредственно соединяющихся друг с другом во внеклеточном пространстве. Хотя в образовании плотных контактов участвуют многочисленные белки, главные из них — клаудины и окклюдины. Различные периферические белки, расположенные на цитоплазматической стороне мембран, соединяют плотные контакты с актиновым цитоскелетом.
Плотные контакты выполняют три основные функции:
- Механически соединяют клетки эпителия
- Обеспечивают барьер для латеральной диффузии белков, благодаря чему сохраняется полярность клеток эпителия. На апикальной (смотрящей в просвет органа или на поверхность тела) поверхности локализованы одни белки, а на базолатеральной (нижне-боковой) — другие. Благодаря этому, например, клетки кишечного эпителия могут поглощать вещества путем активного транспорта или эндоцитоза из просвета кишки и выделять их в кровь (обычно путем пассивного транспорта или экзоцитоза). Для поглощения веществ нужны одни белки, а для их выделения в кровь — другие.
- Обеспечивают барьер на пути большинства веществ, из-за чего эти вещества транспортируются в организм через мембраны и через цитоплазму клеток. Это позволяет отчасти контролировать транспорт веществ (в большей степени, чем когда они просачиваются между клетками).
По степени «плотности» контактов эпителии lелятся на проницаемые и мало проницаемые. К первым относится, например. эпителий почечных капсул и проксимальных извитых трубочек, а ко вторым — эпителий дистальных извитых трубочек почек или капилляров мозга (где плотные контакты обеспечивают гематоэнцефалический барьер).


Десмосома — один из типов межклеточных контактов, обеспечивающих прочное соединение клеток (как правило, эпителиальной или мышечной ткани) у животных. Функции z десмосом заключается главным образом в обеспечении механической связи между клетками.
Существуют 3 типа десмосом — точечные, опоясывающие и гемидесмосомы. Точечная десмосома собой небольшую площадку (диаметром до 0,5 мкм), соединяющую мембраны двух соседних клеток. Количество точечных десмосом на одной клетке может достигать 2000.
Десмосомы образуются между клетками тех тканей, которые могут подвергаться трению, растяжению и другим механическим воздействиям (эпителиальные клетки, клетки сердечной мышцы). Со стороны цитоплазмы к десмосомам прикрепляются промежуточные филаменты, которые формируют в цитоплазме сеть, обладающий большой прочностью на разрыв. Через десмосомы промежуточные филаменты соседних клеток объединяются в непрерывную сеть, охватывающую всю ткань.
Десмосома состоит из белков клеточной адгезии из семейства кадгеринов и соединительных (адапторных) белков, которые соединяют их с промежуточными филаментами. Белки клеточной адгезии, формирующие десмосомы — десмоглеин и десмоколлин. Как и другие кадгерины, эти трансмембранные белки имеют по пять внеклеточных доменов и являются кальцийсвязывающими. Они обеспечивают гомофильное соединение клеток — между собой соединяются две одинаковые по строению молекулы белка. Внутриклеточный белок десмоплакин (при участии еще двух белков, плакофиллина и плакоглобина) соединяет внутриклеточные домены десмоглеина с промежуточными филаментами. Тип промежуточных филаментов зависит от типа клеток: в большинстве эпителиальных клеток они кератиновые, а в клетках сердечной мышцы — десминовые, и т. п.
Если контакты похожего строения образуются между клетками и внеклеточным матриксом, то они называются гемидесмосомами, или полудесмосомами. Хотя по структуре они напоминают десмосомы и тоже содержат промежуточные филаменты, они образованы другими белками. Основные трансмембранные белки гемидесмосом — интегрины и коллаген XVII. С промежуточными филаментами они соединяются при участии дистонина и плектина. Основной белок межклеточного матрикса, к которому клетки присоединяются с помощью гемидесмосом — ламинин.
Медицинское значение
С нарушением функции десмосом связаны кожные болезни, которые объединены под названием «пузырчатка» (pemphigus). Две её наиболее распространенные формы — pemphigus vulgaris (вульгарная пузырчатка) и pemphigus foliaceus (пластинчатая пузырчатка). Обычно они имеют аутоиммунную природу, хотя сходные патологии могут быть и наследственными. При вульгарной пузырчатке антитела атакуют белок десмоглеин-3, который присутствует во всех слоях эпителия. При пластинчатой пузырчатке образуются аутоантитела против белка десмоглеин-1, который экспрессируется только в верхних слоях эпидермиса кожи. У больных образуются пузыри, так как слои эпидермиса разрываются, часть его клеток гибнет, а в образующиеся полости поступает межклеточная жидкость.
При вульгарной пузырчатке пузыри образуются не только на коже, но на других слизистых (в основном во рту). Эта болезнь протекает более тяжело и может закончиться смертью. Развивается она обычно в возрасте 40-60 лет. При пластинчатой пузырчатке поражения захватывают только кожу, которая отслаивается в виде пластинок.
При нарушении функции гемидесмосом развивается буллёзный эпидермолиз (врожденная, буллёзная пузырчатка). При малейшем механическом воздействии эпидермис кожи отстаёт от базальной пластинки, под ним образуются пузыри с серозным или геморрагическим содержимым. Одна из причин этого заболевания — мутации гена коллагена XVII. Данный вариант заболевания наследуется по аутосомно-рецессивному типу.
Высокопроницаемые (щелевые) контакты
[править]
Щелевое соединение, щелевой контакт — способ соединения клеток в организме с помощью белковых каналов (коннексонов). Через щелевые контакты могут непосредственно передаваться от клетки к клетке электрические сигналы (потенциалы действия), а также малые молекулы (с молекулярной массой примерно до 1.000 Д). Этим щелевые контакты отличаются от плазмодесм, через которые могут транспортироваться макромолекулы и даже органоиды.
Структурную основу щелевого соединения составляют коннексоны — каналы, образуемые шестью белками-коннексинами. В нервной системе щелевое соединение между нейронами встречается в так называемых электрических синапсах. Отдельные коннексоны обычно сосредоточены на ограниченных по площади участках мембран — нексусах, или бляшках (англ. plaque) диаметром 0,5-1 мкм. В области нексуса мембраны соседних клеток сближены, расстояние между ними составляет 2-4 нм.
Белки щелевых контактов
У позвоночных основу щелевых контактов составляют коннексины — первое из описанных семейств белков щелевых контактов. В геноме человека идентифицирован 21 ген щелевых контактов, в геноме мыши — 20 генов.
У беспозвоночных имеется другое семейство белков щелевых контактов, сходных с коннексинами по структуре и функциям. но негомологичных им (имеющих несходную первичную структуру) — иннексины. В геноме Caenorhabditis elegans найдено 25 генов иннексинов, в геноме Drosophila melanogaster — 8.
Позднее выяснилось, что у позвоночных, кроме коннексинов, имеются также белки, гомологичные иннексинам. Эти белки, открытые группой российских ученых под руководством Ю. В. Панчина, получили название паннексины. В геноме человека и мыши к настоящему времени идентифицированы 3 гена паннексинов.
У кишечнополостных и иглокожих есть щелевые контакты, но нет генов ни одного из вышеназванных семейств. Это означает, что существуют ещё не открытые семейства белков щелевых контактов.
Другие типы контактов
[править]Адгезионные (адгезивные) контакты образуются между соседними клетками (как правило, 'пиелиальными) или между клетками и межклеточным веществом (фокальные контакты, пятна адгезии). В первом случае трансмембранные белки, обеспечивающие контакт клеток, относятся к семейству кадгеринов; присоединение клетки к межклеточному веществу обеспечивают интегрины. Этим адгезивные контакты сходны с десмосомами и гемидесмосомами. Однако внутри клетки белки этих контактов через различные линкерные белки связываются не с промежуточными фиалментами (как в случае десмосом и гемидесмосом), а с актиновыми микрофиламентами.
[85] Клеточные контакты — Cellbiol.ru
Клеточные стенки растений и бактерий
[править]Цитоскелет и клеточная подвижность
[править]Цитоскелет- система внутриклеточных белковых нитей и трубочек. Цитоскелет участвует в поддержании формы клеток и обеспечивает все формы клеточной подвижности эукариот. Ползание амебы и плавание инфузории, сокращение мышц человека и продвижение растущего аксона к мышце-мишени, расхождение хромосом при митозе и перемещение секреторных пузырьков к наружной мембране - всё эторезультат работы цитоскелета. Таким образом, он выполняет функции не только "клеточных костей", но и "клеточных мышц".
До недавнего времени считалось, что цитосклет есть только у эукариот. Но сейчас известно, что и в клетках прокариот (по крайней мере, некоторых) тоже присутстуют белки, образующие цитоскелет.
Белки «цитоскелета» прокариот
[править]Долгое время считалось, что цитоскелетом обладают только эукариоты. Однако с выходом в 2001 году статьи Jones и соавт. (PMID: 11290328), описывающей роль бактериальных гомологов актина в клетках Bacillus subtilis, начался период активного изучения элементов бактериального цитоскелета. К настоящему времени найдены бактериальные гомологи всех трех типов элементов цитоскелета эукариот — тубулина, актина и промежуточных филаментов (Shih Y.-L., Rothfield L. The Bacterial Cytoskeleton. // Microbiology And Molecular Biology Reviews. — 2006. — V. 70., No. 3 — pp. 729—754. PMID: 16959967). Также было установлено, что как минимум одна группа белков бактериального цитоскелета, MinD/ParA, не имеет эукариотических аналогов.
Бактериальные гомологи актина
К наиболее изученным актиноподобным компонентам цитоскелета относятся MreB, ParM и MamK.
Белки MreB и его гомологи являются актиноподобными компонентами цитоскелета бактерий, играющими важную роль в поддержании формы клетки, сегрегации хромосом и организации мембранных структур. Некоторые виды бактерий, такие как Escherichia coli, имеют только один белок MreB, тогда как другие могут иметь 2 и более MreB-подобных белков. Примером последних служит бактерия Bacillus subtilis, у которой были обнаружены белки MreB, Mbl (MreB-like) и MreBH (MreB homolog).
В геномах E. coli и B. subtilis ген, отвечающий за синтез MreB, находится в одном опероне с генами белков MreC и MreD. Мутации, подавляющие экспрессию данного оперона, приводят к образованию клеток сферической формы с пониженной жизнеспособностью.
Субъединицы белка MreB образуют филаменты, обвивающие палочковидную бактериальную клетку. Они располагаются на внутренней поверхности цитоплазматической мембраны. Филаменты, образуемые MreB, динамичны, постоянно претерпевают полимеризацию и деполимеризацию. Непосредственно перед делением клетки MreB концентрируется в области, в которой будет формироваться перетяжка. Считается, что функцией MreB также является координация синтеза муреина — полимера клеточной стенки.
Гены, отвечающие за синтез гомологов MreB, были обнаружены только у палочковидных бактерий и не были найдены у кокков.
Белок ParM присутствует в клетках, содержащих малокопийные плазмиды. Его функция заключается в разведении плазмид по полюсам клетки. При этом субъединицы белка формируют филаменты, вытянутые вдоль большой оси палочковидной клетки.
Филамент по своей структуре представляет собой двойную спираль. Рост филаментов, образуемых ParM, возможен с обоих концов, в отличие от актиновых филаментов, растущих только на ±полюсе.
MamK — это актинподобный белок Magnetospirillum magneticum, отвечающий за правильное расположение магнитосом. Магнитосомы представляют собой впячивания цитоплазматической мембраны, окружающие частички железа. Филамент MamK выполняет роль направляющей, вдоль которой, одна за другой, располагаются магнитосомы. В отсутствие белка MamK магнитосомы располагаются беспорядочно по поверхности клетки.
Гомологи тубулина
В настоящее время у прокариот найдены 2 гомолога тубулина: FtsZ и BtubA/B. Как и эукариотический тубулин, эти белки обладают ГТФазной активностью.
Белок FtsZ чрезвычайно важен для клеточного деления бактерий, он найден практически у всех эубактерий и архей. Также гомологи этого белка были обнаружены в пластидах эукариот, что является еще одним подтверждением их симбиотического происхождения.
FtsZ формирует так называемое Z-кольцо, выполняющее роль каркаса для дополнительных белков клеточного деления. Вместе они представляют собой структуру, ответственную за образование перетяжки (септы).
BtubA/B
В отличие от широко распространенного FtsZ, эти белки обнаружены только у бактерий рода Prosthecobacter. Они более близки к тубулину по своему строению, чем FtsZ.
Кресцентин, гомолог белков промежуточных филаментов
Кресцентин был найден в клетках Caulobacter crescentus. Его функцией является придание клеткам C. crescentus формы вибриона. В случае отсутствия экспрессии гена кресцентина клетки C. crescentus приобретают форму палочки. Интересно, что клетки двойных мутантов, кресцентин− и MreB−, имеют сферическую форму.
MinD и ParA
Эти белки не имеют гомологов среди эукариот. MinD отвечает за положение сайта деления у бактерий и пластид. ParA участвует в разделении ДНК по дочерним клеткам.
Типы клеточной подвижности прокариот
[править]Строение и принцип работы бактериального жгутика
[править]- [86] — Юрий Свидиненко. Обзор биолгических наномоторов
- [87]Тихонов А. Н. Молекулярные моторы. Часть 1. Вращающиеся моторы живой клетки // Соросовский образовательный журнал, 1999, № 6, с. 8-16.
- [88]Скулачев В. П. Электродвигатель бактерий // Соросовский образовательный журнал, 1998, № 9, с. 2-7.
- [89] Метлина А. Л. Жгутики прокариот как система биологической подвижности. Успехи биологической химии, 2001, т.41, с.229-282
Основные компоненты цитоскелета эукариот
[править]Основные элементы цитоскелета эукариот - микротрубочки, микрофиламенты и промежуточные филаменты.
Микротрубочки - белковые трубочки диаметром около 25 нм. Они состоят из глобулярного белка тубулина. Микрофиламенты похожи на две перекрученные нити бусинок. Они имеют диаметр около 7 нм и состоят из глобулярного белка актина. Промежуточные филаменты похожи на многожильный кабель диаметром около 10 нм. Они состоят в разных клетках из разных фибриллярных белков; например, в клетках эпителиальных тканей животных это белок кератин.
Микротрубочки и микрофиламенты есть во всех клетках эукариот. Промежуточные филаменты в цитоплазме есть не у всех эукариот, а только у некоторых групп животных. причем не во всех клетках. В ядре промежуточные филаменты распространены более широко: видимо, они есть у всех животных и растений.
Основные типы клеточной подвижности эукариот — амебоидное движение, ресничное движение и мышечное сокращение
[править]
Микротрубочки, их строение и функции
[править]
Микротрубочки - трубочки диаметром около 24-25 нм, состоящие из белка тубулина. Микротрубочки есть во всех клетках эукариот и могут собираться в цитоплазме, а у многих эукариот и внутри ядра. Микротрубочки:
- Участвуют в поддержании формы клеток
- Влияют на взаимное расположение органелл (например, ЭПС и аппарата Гольджи)
- Обеспечивают транспорт веществ (по их поверхности, как по рельсам, мс помощью двигательных белков кинезинов и динеинов могут передвигаться мембранные пузырьки с грузом и макромолекулы)
- Составляют основу жгутиков и ресничек эукариот, при участии динеинов обеспечивают ресничное и жгутиковое движение
- Составляют основу центриолей, которые во многих клетках эукариот выполняют роль ЦОМТ - центра организации микротрубочек
- Образуют веретено деления и обеспечивают расхождение хромосом к полюсам клетки в ходе ее деления
Строение молекул тубулина. Структура микротрубочек
[править]Тубулин — глобулярный белок. В клетках эукариот есть несколько слегка различающихся генов-ортологов, которые кодируют три разных формы тубулина — α-тубулин, β-тубулин и γ-тубулин. У каждого из этих белков выделяют три домена. Одна молекула α-тубулина и одна молекула β-тубулина в цитоплазме клеток объединяются в димер (изображен на рисунки). В составе такого димера к каждой молекуле тубулина присоединено по одной молекуле ГТФ.
На самом деле каждую из форм тубулина кодирует не один ген, а около десятка, так что каждая форма существует в виде множества подтипов. Они могут быть специфичны для определенных тканей. Например, тубулин III-β встречается только в нейронах. Кроме того, по одному гену кодируют еще две формы тубулина — δ- и ε-тубулин, которые, как и γ-тубулин, встречаются в основном в центриолях.
Сборка и разборка микротрубочек. Динамическая нестабильность
[править]Новые молекулы тубулина могут прикрепляться как к ±, так и к --концу микротрубочки, но легче (при более низкой концентрации) присоединяются к + -концу (и легче отделяются от --конца).
Тубулин способен связываться в растворе с молекулами ГТФ. Рост микротрубочек осуществляется только за счет присоединения димеров тубулина, в которых обе субъединицы связаны с молекулами ГТФ. В стенках микротрубочек происходит гидролиз ГТФ, связанной с β-субъединицей, до ГДФ (связанная с α-субъединицей ГТФ стабильна). Связанная с ГДФ форма тубулина легче отделяется от микротрубочек, что определяет динамическую нестабильность микротрубочек — при определенных условиях они быстро распадаются почти полностью.
Микротрубочка распадается, когда расщепление ГТФ происходит быстрее, чем присоединение новых димеров. Тогда защитная "шапочка" (кэп) на +-конце из димеров, связанных с ГТФ, разрушается, и после эого быстро отваливаются от микротрубочки димеры, связанные с ГДФ.
[[90]] Анимация сборки и разборки микротрубочки
Микротрубочки участвуют в поддержании формы клеток
[править]Транспортная роль микротрубочек. Строение и функции кинезинов и динеинов
[править]По поверхности микротрубочек, как по рельсам, могут транспортироваться мембранные пузырьки (везикулы) с грузом или макромолекулы. Их перемещение осуществляют две группы моторных белков - кинезины и динеины. Кинезины перемещаются по микротрубочке от --конца к +-концу, то есть обеспечивают транспорт к периферии клеток. Динеины двигаются в противоположном направлении - от +-конца микротрубочки к --концу, то есть обычно перемещают грузы к центру клетки.
Транспорт к периферии клетки часто называют антероградным транспортом, транпорт к центру - ретроградным (особенно эти термины применимы к движению по отросткам клеток - например, аксонам или дендритам. Одно из семейств кинезинов (кинезины-14, в том числе NCD дрозофилы, KAR3 почкующихся дрожжей и ATK5 арабидопсиса, двигаются по микротрубочкам от +-конца к --концу.
[91] Строение и функции кинезинов и динеинов (англ.)
- [92] Видео: Движение органелл по микротрубочкам
Жгутики и реснички (ундулиподии) встречаются у большинства групп эукариот
[править]
Реснички и жгутики — органеллы, которые есть у многих групп эукариот. Это тонкие (диаметром 0,1-0,6 мкм) волосковидные выросты на поверхности клетки. Длина их составляет от 3-15 мкм до 2 мм (реснички гребных пластинок гребневиков).
Жгутики и реснички всех эукариот имеют сходное строение, поэтому иногда их обозначают общим термином ундулиподии. Это сходство — одно из свидетельств единого (монофилетического) происхождения эукариот. Ундулиподии есть у большинства групп протистов, у споровых и некоторых голосеменных растений раст и практически у всех животных. Настоящие грибы (Eumycota) лишены жгутиков и ресничек.
Различие между жгутиками и ресничками на самом деле заключается в характере их движения: реснички совершают удары в одной плоскости, а жгутик вращается (одновременно по нему может пробегать волна). Но в зоологии принято называть жгутиковыми любые клетки, у которых есть один подвижный жгутик (или ресничка). При наличии многочисленных ресничек клетки называют ресничными.
У многих беспозвоночных животных ими покрыта вся поверхность тела (ресничные черви, личинки кишечнополостных и губок) или отдельные его участки (например, жабры у полихет и двустворчатых моллюсков, подошва ноги у брюхоногих моллюсков). У коловраток из специализированных ресничек состоит коловращательный аппарат. У многих беспозвоночных (кишечнополостные, гребневики, турбеллярии и др.) реснички также имеются на клетках кишечного эпителия.
У позвоночных (в том числе человека) клетки с подвижными ресничками также есть во многих органах. У человека ресничным эпителием выстланы дыхательные пути, евстахиевы трубы, семявыносящие канальцы, желудочки мозга и спинномозговой (центральный) канал. Видоизмененные реснички служат световоспринимающим аппаратом фоторецепторов сетчатки глаза и воспринимающим запахи аппаратом хеморецепторов обонятельного эпителия.
Жгутики и реснички выполняют разнообразные функции
[править]Подвижные реснички и жгутики либо служат для движения, либо создают токи жидкости. Эти токи могут приносить пищу или кислород из внешней среды или служить для транспорта растворенных веществ внутри организма. Неподвижные жгутики и реснички (часто сильно видоизмененные) служат рецепторами у самых разных групп организмов.
Строение и функции центриолей
[править]Веретено деления, его строение и работа
[править][93] Видео — веретено деления в раннем эмбрионе дрозофилы
Микрофиламенты, их строение и функции
[править]Микрофиламенты — элементы цитоскелета, свойственные всем клеткам эукариот. Они состоят из белка актина и имеют диаметр 6-7 нм. С актином взаимодействуют многие другие «вспомогательные» белки. Актиновые филаменты могут ветвиться и соединяться поперечными сшивками, образуя трехмерные сети. Обычно эта сеть более густая под наружной мембраной, во внешнем слое цитоплазмы, который называется кортекс. Микрофиламенты участвуют в поддержании формы клетки и формировании выростов на её поверхности — микроворсинок и псевдоподий (ложноножек). Взаимодействуя с миозином, микрофиламенты обеспечивают амебоидное и мышечное движение, а также деление клетки «перетяжкой», характерное для животных. С помощью цитоплазматических миозинов по микрофиламентам могут двигаться пузырьки с грузом; т.о., они участвуют в везикулярном транспорте. С помощью вспомогательных белков микрофиламенты могут присоединяться изнутри к мембране клетки, образуя адгезивные контакты. Эти контакты участвуют в амебоидном движении многих клеток (в том числе внутри многоклеточного организма). С их помощью клетки прикрепляются к межклеточному веществу при ползании. Они могут выполнять и сигнальную функцию, меняя поведение клеток в зависимости от состава окружающей среды.


Сборка и разборка микрофиламентов
[править][94] Анимация "Сборка актиновых филаментов" (англ.)
Мышечное сокращение. Строение и сокращение поперечнополосатых мышц
[править]Тонкое строение поперечно-полосатой мышцы
[править]Основные сократимые элементы скелетных мышц - это экстрафузальные мышечные волокна. (Видоизмененные интрафузальные волокна – мышечные веретена - служат рецепторами растяжения.) Это гигантские многоядерные клетки, имеющие форму цилиндра с заострёнными концами. Длина их в разных мышцах обычно составляет от 1 до 40 мм, а толщина 50-100 мкм. Число ядер может достигать нескольких сотен; располагаются они неглубоко под плазматической мембраной, которая носит специальное название – сарколемма. Сарколемма имеет глубокие впячивания в цитоплазму – Т-трубочки. При сокращении мышца тратит очень много энергии, поэтому в цитоплазме находится большое количество митохондрий, обеспечивающих функционирование основных сократимых элементов мышцы – миофибрилл. Также в цитоплазме находится специализированный ЭПР (см. ниже).
В процессе эмбрионального развития мышечные волокна возникают путем слияния одноядерных клеток-предшественников — миобластов. Часть миобластов дифференцируются в мелкие, с малым количеством цитоплазмы клетки-спутницы. Эти клетки при повреждении мышцы могут начать делиться и сливаться, обеспечивая регенерацию мышечных волокон.
Две трети объёма мышечного волокна занимают миофибриллы, которые, в свою очередь, состоят из нескольких саркомеров. Поперек миофибрилл находятся перегородки, являющиеся границами саркомеров. Эти перегородки называются Z-дисками. Z-диски состоят из альфа-актинина (актин-связывающего белка), винкулина и интегрина. От Z-дисков отходят нити - тонкие филаменты, между ними расположены более толстые пучки - толстые филаменты. Места перекрывания тонких и толстых филаментов под световым микроскопом выглядят, как более темные полосы. Из-за этого мышца получила название поперечно-полосатой. Когда мышца сокращается, длина толстых и тонких филаментов не меняется. Мышца сокращается за счет того, что филаменты скользят по поверхности друг друга.
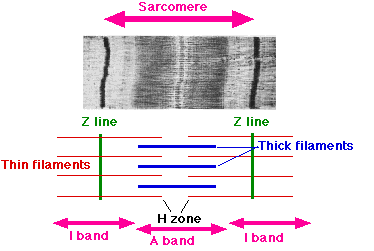
Толстые филаменты состоят из белка миозина. Молекулы миозина симметричны, они состоят из двух половинок, каждая из которых имеет "головку" и "хвост". В толстом филаменте молекулы миозина находятся "хвостом" к "хвосту", а "головки" торчат по краям наружу. Толстые филаменты также соединяются с Z-дисками, но не напрямую, а с помощью специального белка титина. Тонкие филаменты состоят из нескольких белков: актина, тропонина и тропомиозина. Последние два образуют тропонин-тропомиозиновый комплекс. Актин - глобулярный белок, его молекулы имеют форму шариков. Из-за этого тонкий филамент напоминает две перекрученные цепочки бус, в которых каждый шарик– это молекула актина.
Саркоплазматический ретикулум (СР) - специализированный эндоплазматический ретикулум (ЭПР) мышечных клеток поперечнополосатых мышц. По структуре напоминает гладкий ЭПР. СР расположен в непосредственной близости от миофибрилл. Его структуры подразделяются на терминальные цистерны, которые охватывают миофибриллы полукольцом, и продольные трубочки, кторые соединяют соседние терминальные цистерны. К терминальным цистернам СР примыкают Т-трубочки - глубокие впячивания наружной мембраны. Число Т-трубочек примерно соответствует числу саркомеров.
СР служит депо ионов кальция. Концентрация ионов кальция в СР может достигать 10−3 моль, в то время как в цитозоле составляет порядка 10−7 моль (в состоянии покоя).
- [95] Анимация Тонкий филамент скелетной мышцы (англ.)
- [96]- Механизмы развития мышечной ткани (англ.)
Молекулярный механизм скольжения филаментов
[править]У миозина есть два состояния: с вытянутой "головкой" и с согнутой "головкой". Состояние зависит от того, какое вещество находится в его активном центре: АТФ, АДФ + фосфат, просто АДФ или вообще ничего. Если в активном центра находится АТФ или ничего нет, то "головка" будет изогнута. Если же там АДФ + фосфат или АДФ, головка будет вытянута. Связан миозин с актином или нет, тоже зависит от вещества, находящегося в активном центре миозина. Если в нем находится АТФ или АДФ + фосфат, то миозин не будет взаимодействовать с актином. Если там АДФ или ничего, то миозин связывается с актином.

Итак, если в активный центр миозина поступил АТФ, то "головка" белка изогнута, а с актином он не связан. Затем миозин расщепляет АТФ, с образованием АДФ + фосфат. Из-за этого "головка" миозина выпрямляется, но с актином белок еще не связан. После этого из активного центра уходит фосфат. При этом "головка" миозина по-прежнему выпрямлена, и миозин связывается с актином. Потом из активного центра уходит и АДФ. Поскольку в нем ничего не осталось, головка миозина изгибается, не отрываясь при этом от актина. В результате миозин будет подтягивать весь тонкий филамент. Наконец, активный центр миозина связывает еще одну молекулу АТФ, миозин отсоединяется от актина, весь цикл повторяется, и тонкий филамент подтягивается еще на один шаг.
Регуляция мышечного сокращения
[править]Нейромедиатор ацетилхолин воздействует на ацетилхолиновые рецепторы - гетероолигомерные комплексы, состоящие из 5 субъединиц (2α, β, γ, δ). Трансмембранная часть рецептора образует ионный канал, стенки которого сформированы сегментами всех пяти субъединиц. 2 молекулы ацетилхолина связываются с α-субъединицами рецептора, из-за чего рецептор меняет свою конформацию, что приводит к открытию Na+/K+-каналов примерно на 1 миллисекунду, ионы натрия входят в клетку, ионы калия выходят из клетки - происходит деполяризация наружной мембраны мышечной клетки. Потенциал действия мышцы распространяется по сарколемме и внутрь Т-трубочек. На мембране Т-трубочек открываются потенциалзависимые кальциевые ионные каналы L-типа (дигидропиридиновые рецепторы), связанные с кальциевыми ионными каналами СР (рианодиновыми рецепторами). В результате ионы кальция поступают из внеклеточной среды и СР в межфибриллярное пространство. Обратно ионы кальция попадают в СР с помощью мембранных кальциевых насосов — Ca2+-АТФазы. Ранее полагали, что между кальциевыми каналами и мембраной Т-трубочек имеется домен белка, который обеспечивает механическое сопряжение деполяризации с открыванием канала. Однако теперь преобладает точка зрения, согласно которой при деполяризации открываются кальциевые каналы на Т-трубочке, первые порции ионов кальция входят в клетку извне, связываются с цитоплазматическим доменом кальциевых ионных каналов СР и вызывают их открывание.
На поверхности тонкого филамента находится тропонин-тропомиозиновый комплекс, который состоит из соединенных белков тропонина и тропомиозина. Тропомиозин механически мешает миозину взаимодействовать с актином. Тропонин же при наличии Ca2+ связывается с этим ионом, изменяет свою конформацию и смещается в сторону. Вместе с ним сдвигается и тропомиозин, т.к. эти белки очень тесно связаны. Сместившись, тропомиозин больше не мешает связи между миозином с актином.
Когда концентрация ионов кальция в саркоплазме возрастет до 10 мкМ/л, эти ионы могут связаться с С-субъединицей тропонина. В результате тропонин-тропомиозиновый комплекс смещается из-за изменения конформации тропонина С, и на актиновых микрофиламентах открываются места связывания для "головок" миозина.
Нервно-мышечный синапс — эффекторное нервное окончание на скелетном мышечном волокне. Нервный отросток, проходя к сарколемме, утрачивает миелиновую оболочку и образует с ней систему складок, похожих на глубокие карманы. Пресинаптическая мембрана аксона и постсинаптическая мембрана мышечного волокна разделены синаптической щелью. В этой области мышечное волокно не имеет поперечной исчерченности, зато тут есть скопление митохондрий и ядер. Терминали аксонов содержат большое количество митохондрий и синаптических пузырьков с медиатором ацетилхолином. Некоторые вещества могут влиять на процесс выделения медиатора в синаптическую щель: карбахолин усиливает выделение ацетилхолина на уровне пресинаптических окончаний, а ботулотоксин препятствует высвобождению медиатора. На постсинаптической мембране находятся чувствительные к нему холинорецепторы, сложные белковые молекулы. На пресинаптической мембране их нет, поэтому обратная передача сигнала невозможна.
-
1. Пресинаптическое окончание
2. Сарколемма
3. Синаптический пузырек
4. Никотиновый ацетилхолиновый рецептор
5. Митохондрия
При деполяризации пресинаптической терминали открываются потенциал-чувствительные кальциевые каналы, ионы кальция входят в пресинаптическую терминаль и запускают механизм слияния синаптических пузырьков с мембраной. Открыты два механизма высвобождения нейромедиатора: с полным слиянием везикулы с плазмалеммой и так называемый «поцеловал и убежал» (англ. kiss-and-run), когда везикула соединяется с мембраной, и из неё в синаптическую щель выходят небольшие молекулы (ацетилхолин), а крупные остаются в везикуле. Второй механизм предположительно быстрее первого, с помощью него происходит синаптическая передача при высоком содержании ионов кальция в синаптической бляшке. Слияние везикул с мембраной обеспечивают белки группы v-SNARE. У белков этой группы SNARE-домен (около 60 аминокислот) отвечает за образование обратимой, но прочной четырёхспиральной сцепки. Такой метастабильный транс-SNARE комплекс включает синтаксин 1 и SNAP-25, находящиеся на клеточной мембране, и синаптобревин на поверхности доставляемой пресинаптической везикулы. Синтаксин и синаптобревин связаны с мембраной С-коцевым фрагментом и предоставляют по одной альфа-спирали в четырёхспиральную сцепку комплекса. SNAP-25 заякорен на мембране за счёт пальмитоильных ацильных цепей и обеспечивает две оставшиеся альфа-спирали. В результате медиатор выходит в синаптическую щель и присоединяется к белкам-рецепторам постсинаптической мембраны. Холинорецептор нервно-мышечных синапсов включает 5 белковых субъединиц (α, α, β, γ, δ), окружающих ионный (натриевый) канал и проходящих через всю толщу липидной мембраны. Две молекулы ацетилхолина взаимодействуют с двумя α-субъединицами, что приводит к открыванию ионного канала и деполяризации постсинаптической мембраны. Ацетилхолин действует недолго, потому что разрушается ацетилхолинэстеразой(В нервно-мышечных синапсах - ее т-версией). Она катализирует гидролиз нейромедиатора ацетилхолина до холина и остатка уксусной кислоты. т-ацетилхолинэстераза представляет собой асимметричную белковую молекулу с "хвостом" из коллагеновой субъединицы, которая прикрепляет его к постсинаптической мембране.
Из-за снижения концентрации нейромедиатора закрываются Na+-каналы на мембране мышечной клетки, мембрана реполяризуется. После реполяризации мембраны ионы кальция выкачиваются из цитоплазмы в СР, и за время порядка 30 мс их концентрация возвращается к исходной. Этот процесс обеспечивается белком — кальциевым насосом (Са-АТФаза, Са2+-АТФаза), который в больших количествах содержится в мембране СР. Са-АТФаза активируется при связывании двух ионов кальция с цитоплазматической стороны [97], так что её активация происходит при повышении концентрации ионов кальция в цитоплазме.
[98] Анимация «Сокращение поперечнополосатой мышцы» (англ.текст)
Взаимодействие с немышечными миозинами и транспортная роль микрофиламентов
[править]"Шагание" молекулы миозина V по актиновому микрофиламенту
Амебоидное движение
[править]Роль микрофиламентов в поддержании формы клеток
[править]Промежуточные филаменты, их строение и функции
[править][99] Анимация «Строение промежуточных филаментов» (англ. текст)
Промежуточные филаменты (ПФ) — элементы цитоскелета, состоящие из сходных по строению и функциям белков. Своё название они получили из-за того, что их диаметр — около 10 нм — промежуточный между диаметром микрофиламентов и микротрубочек. К белкам ПФ относятся ламины, из которых состоит внутренняя выстилка ядерной оболочки, и цитоплазматические белки, различающиеся в разных клетках. Ламины есть у большинства эукариот, цитоплазматические ПФ — только у некоторых животных, причем не во всех тканях. Так, ламины есть у нематод, моллюсков и позвоночных, но не найдены у членистоногих и иглокожих.
Сборка и разборка промежуточных филаментов
[править]
Две молекулы кератина (или иного белка ПФ), имеющие вытянутую форму, закручиваются друг вокруг друга, образуя гомо- или гетеродимер. При этом они направлены "голова к голове " (NH2-концы обеиз молекул смотрят в одну и ту же сторону). Затем два таких димера объединяются в тетрамер «головой к хвосту». Из таких тетрамеров собираются протофиламенты, а затем 8 протофиламентов объединяются в ПФ диаметром около 10 нм.
Тетрамеры удерживаются вместе в основном за счет гидрофильно-гидрофобных взаимодействий. Между отдельными ПФ образуются дисульфидные мостики; это придаёт сетям из ПФ особую прочность и делают их малорастворимыми. Сети из ПФ сохраняют целостность даже после гибели клетки (из таких заполненных кератином мертвых клеток состоит верхний слой кожи, волосы, ногти и другие роговые структуры у наземных позвоночных).
Мономеры и димеры белков ПФ, в отличие от димеров тубулина и мономеров актина, не связывают трифосфатнуклеотиды. Регуляция сборки и разборки ПФ изучена плохо. Видимо, в некоторых случаях их быстрая разборка происходит за счет фосфорилирования (как и распад ядерной оболочки из ламинов).
Ядерные ламины поддерживают форму ядра, обеспечивают целостность ядерной оболочки и прикрепление хромосом
[править]
Ядерная ламина прилегает к внутренней поверхности внутренней ядерной мембраны (INM) и помогает поддерживать ядро в стабильном состоянии, участвует в организации хроматина, связывает ядерные поры. В профазе митоза или мейоза у многих организмов белки ядерной ламины фосфорилируются, и это приводит к распаду ядерной оболочки.
Также ядерная ламина взаимодействует с белками ядерной оболочки. Число известных белков, взаимодействующих с ламиной, постоянно растёт благодаря новым открытиям. Белки отмечены пурпурным цветом. Среди белков, связывающихся с ядерной ламиной — несприн, эмерин, LAP1, LAP2, рецептор ламина B (LBR) и MAN1. К ламине присоединяются факторы транскрипции, такие как retinoblastoma transcriptional regulator (RB), germ cell-less (GCL), sterol response element binding protein (SREBP1), FOS and MOK2. Barrier to autointegration factor (BAF) — связанный с хроматином белок,
который также присоединяется к ламинам и некоторым из вышеупомянутых белков. Белок гетерохроматина-1 (HP1) связывается с хроматином и LBR.
Мутации генов, кодирующих ламины, вызывают редкие расстройства, объединяемые в группу ламинопатий. Мутация гена LMNA, кодирующего ламин A, вызывает синдром прогерии Хатчинсона-Гилфорда — исключительно редкое заболевание, вызывающее по неизвестным причинам ускоренное старение: большинство пациентов не доживает до 13 лет.
Состав промежуточных филаментов различается в разных тканях
[править]В эпителиальных тканях ПФ состоят из различных кератинов. В клетках и тканях мезодермального происхождения (например. в фибробластах) ПФ состоят из белка виментина. В мышечных клетках присутствуют ПФ, образованные десмином. В большинстве типов нервных клеток присутствуют белки нейрофиламентов.
Промежуточные филаменты эпителиальных клеток состоят из множества разных кератинов
[править]В геноме человека содержится несколько десятков генов белков-кератинов. В эпителиальных клетках обычно одновременно экспрессируются несколько таких генов.
Промежуточные филаменты эпителиальных клеток обеспечивают механическую прочность эпителиальных пластов
[править]ПФ участвуют в образовании межклеточных контактов эпителиальных клеток — десмосом и гемидесмосом.
Промежуточные филаменты других тканей также важны для их функционирования
[править]Взаимодействие различных систем цитоскелета в клетках эукариот
[править]Одномембранные органоиды — обзор
[править]
Компартменты эукариотической клетки:
Роль компартментализации в клетках эукариот
[править]Компартмент - участок клетки, ограниченный двойной мембраной, в котором проходят специфические для данного компартмента биохимические процессы. Таким образом, не каждый органоид является компартментом, но компартмент - это органоид.
Компартментализация - дань специализации различных отделов одной клетки. Её смысл состоит в увеличении эффективности биохимических процессов.
Единая мембранная система клетки
[править]Эндоплазматическая сеть, ее функции
[править]Эндоплазматический ретикулум (ЭПР) или эндоплазматическая сеть (ЭПС) - клеточный компартмент, образующий сложную сеть из уплощённых мембранных мешочков или трубочек, называемых цистернами. Эта структура открыта в 1945 году американским учёным Кейтом Портером посредством электронной микроскопии. [9]
Строение ЭПР
[править]Диаметр просвета (или люмена) ЭПР варьирует от 20 нм до нескольких мкм в зависимости от функциональной активности клетки. ЭПР подразделяется на гладкий (англ. "smooth"), или агранулярный, и шероховатый (англ. "rough"), или гранулярный.
ГЭПР отличается наличием сидячих рибосом на своих стенках; они и обсулавливают различия в функциях Г и АЭПР. Может быть представлен в цитоплазме или разрозненными, относительно редкими цистернами, или в виде локальных скоплений мембран (цитоплазма с такими скоплениями называется эргастоплазмой). Первый тип характерен для клеток с низкой метаболической активностью, второй - клеткам, активно секретирующим белки (например, клеткам печени, железистым клеткам растений).
-
Трёхмерная отрисовка ЭПР
-
Электронная микрофотография среза эукариотической клетки близ ядра (изображено слева внизу)
Функции ЭПР
[править]Агранулярный ЭПР выполняет следующие функции:
- Синтез и транспорт липидов и стероидов
- Накопление и преобразование углеводов
- Нейтрализация ядов
- Депонирование Ca2+
Главной функцией гранулярного ЭПР является синтез белков, причём на ГЭПР синтезируются белки, предназначенные для секреции, отсюда не менее важна функция транспорта продуктов синтеза. Оба этих процесса могут проходить как совместно, так и раздельно. Нужные же клетке белки синтезируются на рибосомах, свободно плавающих в цитоплазме.
Стресс ЭПР
[править]Аппарат Гольджи, его функции
[править]
Из-за достаточно большого размера аппарат Гольджи (АГ) был обнаружен одним из первых среди органелл клетки. АГ был открыт в 1897 году итальянским врачом Камилло Гольджи в ходе его исследований нервной системы. После первого наблюдения он назвал АГ внутренним ретикулярным аппаратом, но вскоре органелла была переименована — названа в честь первооткрывателя. Однако некоторые сомневались в открытии новой органеллы, утверждая, что обнаруженная структура была просто оптической иллюзией, созданной техникой, используемой Гольджи. С развитием современных микроскопов в XX веке открытие было подтверждено.
Аппарат Гольджи найден и в растительных, и в животных клетках. Аппарат Гольджи хорошо развит у клеток, выполняющих секреторные функции (например, у клеток поджелудочной железы). АГ – одномембранный органоид. Он состоит из стопок мембранных структур, называемых цистернами. Кроме цистерн, в АГ присутствует множество мембранных пузырьков — везикул.
У аппарата Гольджи есть несколько важных функций.
1. Аппарат Гольджи участвует в изменении, сортировке и упаковке синтезируемых клеткой макромолекул для секреции ( экзоцитоза) или использования внутри клетки. При сортировке белков аппарат Гольджи модифицирует их. Для того, чтобы опознать и направить по нужному адресу белок, к нему в аппарате Гольджи прикрепляется специальная углеводная метка. Например, метка белка, который должен быть доставлен в лизосому – манноза-6-фосфат.
2. Аппарат Гольджи участвует в транспорте липидов и создании лизосом.
Аппарат Гольджи присутствует в большинстве эукариотических клеток. Хотя цистерны, похожие на аппарат Гольджи, не обнаружены в клетках ряда протистов (лямблий, дизентерийных амеб и др.), недавние молекулярно-биологические исследования показали, что и у них есть гены белков, обычно работающих у других протистов и животных в аппарате Гольджи. Вероятно, АГ уже имелся у последнего общего предка эукариот и был утрачен некоторыми протистами вторично.
Эндосомы и лизосомы, их функции. Вакуоли клеток растений и грибов
[править]Пероксисомы, их функции
[править]Транспорт белков, секреция и внутриклеточное пищеварение
[править]Свободные и сидячие рибосомы: попадание белков в ЭПС
[править]Рибосомы - внутриклеточные органоиды, осуществляющие синтез белков. От синтезируемого в данный момент белка зависит расположение рибосомы в клетке.
"Свободные" рибосомы плавают в цитоплазме, не прикрепляясь к мембранам. Эти рибосомы синтезируют белки, которые работают в цитоплазме или поступают из цитоплазмы в митохондрии, пластиды и ядро. Например, протонная АТФ-синтетаза - белок, работающий в митохондриях; следовательно, рибосома, которая её синтезирует- "свободная". Миозин - двигательный белок, работающий в цитоплазме клетки, также синтезируется "свободными" рибосомами. ДНК-полимераза синтезируется "свободными" рибосомами, т.к. находится в ядре.
"Сидячие" рибосомы прикреплены к мембранам шероховатой эндоплазматической сети (ЭПС). Эти рибосомы синтезируют белки, поступающие в ЭПС. Большинство из таких белков затем поступает в АГ, а оттуда - в лизосомы, на наружную мембрану или во внеклеточную среду (секреция). Например, рецептор SRP - белок, который работает на мембране ЭПС, а следовательно рибосома, синтезирующая его - "сидячая". Белок коллаген выделяется во внешнюю среду; значит, рибосома - "сидячая".
Котрансляционный транспорт в ЭПР
[править]Транспорт белков в ЭПР осуществляется по мере их синтеза, так как рибосомы, синтезирующие белки с сигнальной последовательностью для ЭПР, «садятся» на специальные транслокационные комплексы на мембране ЭПР.
Сигнальная (лидерная) последовательность для ЭПР включает обычно 5-10 преимущественно гидрофобных аминокислот и расположена на N-конце белка. В ее удаленной от конца части имеется консенсусная последовательность, узнаваемая специфической протеазой (за счет этого лидерные последовательности удаляются после завершения синтеза белка). Сигнальная последовательность опознаётся специальным комплексом — «опознающей сигнал частицей» (signal-recognition particle, SRP). В состав SRP входит шесть белков и короткая молекула РНК.

Этапы синтеза и транспорта белков в ЭПР:
- Один участок SRP связывает сигнальную последовательность, а другой связывается с рибосомой и блокирует трансляцию. Отдельный домен SRP отвечает за связывание с SRP-рецептором на мембране ЭПР.
- Вместе с SRP рибосома перемещается к ЭПР и связывается с рецептором SRP (интегральным белком) на цитозольной стороне мембраны ЭПР. Этот комплекс (рибосома — SRP — рецептор SRP) связывается с порой — транслокатором белка на мембране ЭПР. Обычно с мРНК связаны несколько рибосом, и на мембране ЭПР сидят полирибосомы, причем каждая рибосома присоединена к своей поре. Дойдя до 3'-конца мРНК, рибосома возвращается в цитоплазму, однако мРНК удерживается у мембраны ЭПР за счет того, что новые рибосомы, cвязанные с SRP, присоединяются к ее 5'-концу.
- После связывания с транслокатором комплекс SRP — рецептор SRP отделяется от рибосомы, и это приводит к возобновлению трансляции. Сейчас доказано, что белок по мере трансляции проникает в ЭПР через водный канал транслокатора, имеющий воротный механизм и сформированный у эукариот четырьмя субъединицами комплекса Sec61 (гомологичные белки есть и на мембранах бактериальных клеток).
- После возобновления трансляции гидрофобный участок сигнальной последовательности остается связан с транслокатором, а вновь синтезируемый белок в виде петли проталкивается внутрь ЭПР. Этот процесс не требует дополнительных затрат энергии АТФ. После того, как С-конец белка отделяется от рибосомы и оказывается внутри ЭПР, протеаза сигнальной последовательности отрезает ее от белка. Белок внутри ЭПР сворачивается, приобретая нормальную конформацию, а сигнальный пептид через открывшийся в транслокаторе боковой канал перемещается в липидный бислой мембраны ЭПР, где быстро разрушается протеазами.
Попавший в ЭПР белок остается в этой органелле, если имеет специальную «удерживающую в ЭПР» (ER-retaining) последовательность из четырех аминокислот на С-конце. Некоторые из остающихся в ЭПР белков играют важную роль в сворачивании и посттрансляционной модификации проходящих через ЭПР белков. Так, фермент дисульфид-изомераза катализирует окисление свободных SH-групп цистеина и образование дисульфидных связей, а белок-шаперон BiP препятствует неправильному сворачиванию и аггрегации белков до образования ими четвертичных структур, а также способствует удержанию связанных с ним белков в ЭПР.
Встраивание белков в мембраны ЭПР
[править]Похожий, но более сложный механизм обеспечивает котрансляционное встраивание трансмембранных белков в мембрану ЭПР.
[100] - Видео с описанием транслокации белка в ЭПР. Также описан процесс встраивания в мембрану. Третье издание "Молекулярной биологии клетки" Б. Альбертса и др.
Посттрансляционный транспорт в ЭПР
[править]Существует также посттранляционный транспорт белков в ЭПР (более обычный у дрожжей), при котором полностью синтезированный белок связывается в цитозоле с шаперонами, а затем переносится в ЭПР через транслокатор при участии шаперонов семейства Hsp70. Этот вид транспорта является АТФ-зависимым. Для транспорта пептидов (длиной преимущественно в 8-16 аминокислот) из цитозоля в ЭПР для последующей их презентации в комплексе с молекулами MHC-I существует специальный транслокатор — TAP-белок.
Транспорт белков из ЭПР в аппарат Гольджи
[править]Белки поступают из ЭПР в АГ внутри окаймленных мембранных пузырьков, оболочка которых образуется из белка COP-II. Все правильно свернутые белки попадают в такие пузырьки «по умолчанию» и перемещаются в АГ, а затем некоторые из них возвращаются в ЭПР. Однако белки со специальными сигнальными метками концентрируются в транспортных пузырьках, а белки без таких меток попадают туда в небольшом количестве. Отделившиеся от ЭПР пузырьки, лишившись оболочек, сливаются в трубчато-везикулярные кластеры, которые с помощью моторных белков перемещаются по микротрубочкам к АГ. От этих кластеров (как и от цис-Гольджи) отделяются пузырьки, одетые белком COP-I, обеспечивающие обратный транспорт резидентных белков в ЭПР. Возврат белков в ЭПР обеспечивается короткой сигнальной последовательностью на их С-конце, которая связывается либо непосредственно с COP-I (для мембранных белков), либо со специфическим рецептором, взаимодействующим с COP-I (для растворимых белков). Лишенные этих последовательностей белки преимущественно остаются в АГ.
Заключённые в пузырьки белки постепенно перемещаются из цис-Гольджи в транс-Гольджи. По мере перемещения белков внутри АГ ферменты гликозилтрансферазы осуществляют модификацию их олигосахаридных «меток». С помощью подобных ферментов в АГ происходит синтез гликопротеидов — муцинов и протеогликанов.
Основная функция аппарата Гольджи — сортировка белков
[править]Транспорт белков в лизосомы
[править]Транспорт белков из АГ в лизосомы
[править]Мембранные белки и пищеварительные ферменты лизосом поступают из транс-Гольджи в составе окаймленных клатрином пузырьков в раннюю эндосому, а оттуда — в лизосомы. Для попадания лизосомальных ферментов (кислых гидролаз) в лизосомы на них должна присутсвовать специальная метка — остатки маннозо-6-фосфата на концах олигосахаридных цепей.
Эта метка наносится в два этапа. Сперва в цис-Гольджи фермент N-ацетилглюкозаминфосфотрансфераза присоединяет к олигосахаридам остатки N-ацетилглюкозаминфосфата, а затем в транс-Гольджи второй фермент отщепляет N-ацетилглюкозамин.
Метка наносится на те белки, которые имеют специфические черты третичной структуры — «сигнальный бугорок» (signal patch). Затем маннозо-6-фосфаты опознаются специфическим мембранным рецептором, к которому присоединяются гидролазы. В эндосомах при понижении рН гидролазы отделяются от рецепторов. Затем рецепторы в составе специальных пузырьков доставляются обратно а АГ.
Мутации гена N-ацетилглюкозаминфосфотрансферазы приводят к развития тяжелой формы мукополисахаридоза — I-клеточной болезни. При этом заболевании все ферменты лизосом секретируются во внеклеточную среду.
Транспорт белков из внешней среды в лизосомы
[править]Даже в норме часть лизосомальных ферментов выделяется из клетки, а часть мембранных белков лизосом попадает на её наружную мембрану. Из внеклеточной среды лизосомальные ферменты могут поглощаться путем эндоцитоза и доставляться в лизосомы (см. [2]).
Транспорт белков из цитоплазмы в лизосомы
[править]Кроме везикулярного транспорта из АГ, существует и другой путь транспорта белков в лизосомы. Так, при шаперон-опосредованной аутофагии происходит направленный транспорт частично денатурировавших белков из цитоплазмы сквозь мембрану лизосомы в ее полость, где они перевариваются. Этот тип аутофагии, описанный только для млекопитающих, индуцируется стрессом. Она происходит при участии цитоплазматических белков-шаперонов семейства hsр-70, вспомогательных белков и LAMP-2, который служит мембранным рецептором комплекса шаперона и белка, подлежащего транспорту в лизосому. В антиген-презентирующих клетках (например, в дендритных клетках) транспорт пептидов, презентируемых в комплексе с MHC-II, может происходить прямо в лизосомы с помощью белка-транслокатора TAPL.
Транспорт белков в ядро и из ядра
[править]
В ядро и из ядра белки транспортируются через ядерные поры. Через ядерную пору может одновременно транспортироваться до 500 макромолекул в обоих направлениях. Белки (пептиды) с молекулярной массой до 5.000 дальтон свободно диффундируют через ядерные поры (так что их концентрация в цитоплазме и в ядре одинаковая). Путем пассивного транспорта (диффузии) через поры могут проникать белки с молекулярной массой до 60.000 дальтон.
Из более крупных белков в ядро попадают только обладающие сигнальной последовательностью для ядра (это один или два коротких участка белка, богатых остатками положительно заряженных аминокислот — аргинина или лизина). С этой последовательностью связываются специальные белки — рецепторы импорта в ядро (иногда с помощью дополнительных адаптерных белков). Рецепторы импорта в ядро связываются также с компонентами ядреных пор. Энергию для транспорта обеспечивает гидролиз ГТФ, осуществляемый малыми мономерными ГТФ-азами — Ran-белками. В цитоплазме Ran-белок находится в связанном с ГДФ виде, так как в цитоплазме локализованы Ran-GAP белки (белки-активаторы ГТФ-азной активности Ran), а в ядре Ran-белок находится в связанном с ГТФ виде, так как в ядре локализован белок, обеспечивающий обмен ГДФ на ГТФ. Ran-ГТФ, связываясь на внутренней стороне ядреной поры с «нагруженным» рецептором импорта в ядро, обеспечивает его прохождение внутрь ядра и разгрузку. Затем рецептор с присоединенным Ran-ГТФ выходит в цитоплазму, где GAP-белок вызывает гидролиз ГТФ и отделение Ran-ГДФ от рецептора импорта в ядро.
Аналогичный механизм обеспечивает экспорт белков из ядра, только эти белки должны обладать иной сигнальной последовательностью, с которой связываются рецепторы экспорта из ядра (белки, сходные по структуре с рецепторами импорта).
Подробнее этот вопрос рассмотрен в разделе Транспорт веществ через ядерные поры.
Транспорт белков из аппарата Гольджи на наружную мембрану
[править]Белки, встроившиеся в мембрану ЭПС и попавшие оттуда в составе везикул в АГ, могут перемещаться на наружную мембрану клетки. Их направление к мембране осуществляется благодаря взаимодействию везикул с микротрубочками цитоскелета и благодаря особым стыковочным белкам, которые обеспечивают слияние везикул с мембраной.
Секреторная функция аппарата Гольджи
[править]Эндоцитоз — способ поглощения клеткой веществ, при котором поглощаемые вещества окружаются мембраной и первоначально попадают в пузырек из мембраны.
Фагоцитоз — поглощение клеткой крупных оформленных частиц (обычно видимых в световой микроскоп, то есть размером не меньше сотен нанометров). Типичный пример фагоцитоза - поглощение бактерий амебой или клеткой-фагоцитом в теле человека.
Пиноцитоз — поглощение клеткой более мелких частиц: растворенных макромолекул (чаще всего белков) или их комплексов (например, поглощение ЛПНП клетками печени из плазмы крови).
В целом механизмы фагоцитоза и пиноцитоза очень сходны; принципиальной разницы и четкой границы между этими процессами нет, хотя одно отличие все-таки можно указать. При пиноцитозе (если он рецептор-опосредованный, см. ниже) одна молекула рецептора обычно связывает одну молекулу лиганда; при фагоцитозе несколько молекул рецепторов связываются с поглощаемой частицей.
Типичный эндоцитоз встречается у эукариот, лишенных клеточной стенки - животных и многих протистов. Долгое время считалось, что прокариоты полностью лишены способности к эндоцитозу. Однако в 2010 г была опубликована статья, сообщающая об открытии эндоцитоза у бактерий рода Gemmata.

[101] — Анимация пиноцитоза (на примере поглощения холестерина в составе ЛПНП) (англ.текст)
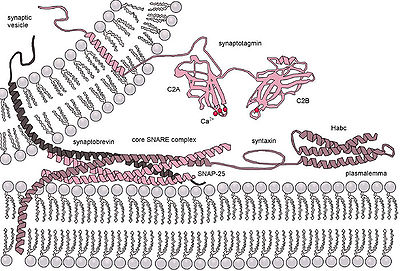
Экзоцитоз есть как у эукариот, так иу прокариот. Экзоцитоз (от греч. Έξω — внешний и κύτος — клетка) у эукариот — клеточный процесс, при котором внутриклеточные везикулы (мембранные пузырьки) сливаются с наружной клеточной мембраной. При экзоцитозе содержимое секреторных везикул (экзоцитозных пузырьков) выделяется наружу, а их мембрана сливается с клеточной мембраной. Практически все макромолекулярные соединения (белки, пептидные гормоны и др.) выделяются из клеток эукариот этим способом.
У прокариот везикулярный механизм экзоцитоза не встречается, у них экзоцитозом называют встраивание белков в клеточную мембрану (или в наружную мембрану у грамотрицательных бактерий), выделение белков из клетки во внешнюю среду или в периплазматическое пространство [10].
Экзоцитоз может выполнять различные задачи:
- доставка на клеточную мембрану липидов, необходимого для роста клетки;
- доставка на клеточную мембрану мембранных белков, таких как рецепторы или белки-транспортёры. При этом часть белка, которая была направлена внутрь секреторной везикулы, оказывается выступающей на наружной поверхности клетки;
- выделение различных веществ из клетки; это могут быть, например, непереваренные остатки пищи у фаготрофных протистов, пищеварительные ферменты у животных с полостным пищеварением, белки межклеточного вещества у животных и материал клеточной стенки у растений, сигнальные молекулы (гормоны или нейромедиаторы).
У эукариот различают два типа экзоцитоза:
- Кальций-независимый конститутивный экзоцитоз встречается практически во всех эукариотических клетках. Это необходимый процесс для построения внеклеточного матрикса и доставки белков на внешнюю клеточную мембрану. При этом секреторные везикулы доставляются к поверхности клетки и сливаются с наружной мембраной по мере их образования.
- Кальций-зависимый неконститутивный экзоцитоз встречается, например, в химических синапсах, где служит для выделения нейромедиаторов. При этом типе экзоцитоза секреторные пузырьки накапливаются в клетке, а процесс их высвобождения запускается по определённому сигналу, опосредованному быстрым повышением концентрации ионов кальция в цитозоле клетки. В пресинаптических мембранах процесс осуществляется специальным кальций-зависимым белковым комплексом [w:[SNARE|]].
Внутриклеточное пищеварение
[править]Механизм внутриклеточного пищеварения
[править]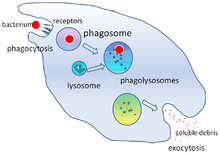
Роль внутриклеточного пищеварения для животных
[править]Аутофагия, её роль
[править]
Аутофагия (от др.-греч. αὐτός — сам и φαγεῖν — «есть»), «самопожирание» — это процесс, при котором компоненты клетки доставляются внутрь её лизосом и подвергаются в них деградации.
Сейчас различают три типа аутофагии — микроаутофагию, макроаутофагию и шаперон-зависимую аутофагию.
При микроаутофагии, как при образовании мультивезикулярных телец, образуются впячивания мембраны эндосомы или лизосомы, которые затем отделяются в виде внутренних пузырьков, только в них попадают вещества, синтезированные в самой клетке. Таким путем клетка может переваривать белки при нехватке энергии или строительного материала (например, при голодании). Но процессы микроаутофагии происходят и при нормальных условиях и в целом неизбирательны. Иногда в ходе микроаутофагии перевариваются и органоиды; так, у дрожжей описана микроаутофагия пероксисом и частичная микроаутофагия ядер, при которой клетка сохраняет жизнеспособность.
При макроаутофагии участок цитоплазмы (часто содержащий какие-либо органоиды) окружается мембранным компартментом, похожим на цистерну эндоплазматической сети. В результате этот участок отделяется от остальной цитоплазмы двумя мембранами. Такие двухмембранные органеллы, окружающие удаляемые органеллы и цитоплазму, называются аутофагосомы. Аутофагосомы соединяются с лизосомами, образуя аутофаголизосомы, в которых органеллы и остальное содержимое аутофагосом перевариваются.
Видимо, макроаутофагия также неизбирательна, хотя часто подчеркивается, что с помощью нее клетка может избавляться от «отслуживших свой срок» органоидов (митохондрий. рибосом и др.).
Третий тип аутофагии — шаперон-опосредованная. При этом способе происходит направленный транспорт частично денатурировавших белков из цитоплазмы сквозь мембрану лизосомы в ее полость, где они перевариваются. Этот тип аутофагии, описанный только для млекопитающих, индуцируется стрессом. Она происходит при участии цитоплазматических белков-шаперонов семейства hsc-70, вспомогательных белков и LAMP-2, который служит мембранным рецептором комплекса шаперона и белка, подлежащего транспорту в лизосому.
При аутофагическом типе клеточной гибели перевариваются все органеллы клетки, оставляя лишь клеточный дебрис, поглощаемый макрофагами.
Патологии при нарушениях внутриклеточного пищеварения
[править]Клетки и межклеточное вещество
[править]Образование и состав межклеточного вещества
[править]Взаимодействия клеток с межклеточным веществом
[править]Транспорт белков в ядро, митохондрии и хлоропласты. Деградация белков
[править]Транспорт белков в митохондрии и хлоропласты
[править]Деградация белков. Строение и работа протеасом
[править]


Белки не вечны. Они вступают в химические реакции, в результате которых «портятся», утрачивают работоспособность. Поэтому практически все белки в клетке и в организме регулярно заменяются. «Испорченные» белки внутри клеток метятся с помощью специального белка — убиквитина. Помеченные убиквитином белки поступают в специальные органоиды — протеасомы, внутри которых распадаются на отдельные аминокислоты.
Убиквити́н (от англ. ubiquitous — вездесущий) — небольшой консервативный белок, который у эукариот может присоединяться к другим белкам. Убиквитинирование — это посттрасляционное присоединение ферментами убиквитин-лигазами одного или, чаще, нескольких мономеров убиквитина с помощью ковалентной связи к боковым аминогруппам белка-мишени. Присоединение убиквитина влияет на внутриклеточную локализацию и функцию белков. Самым первым открытием роли убиквитина в клетке стало доказательство его участия в деградации белков. Белки, помеченных мультиубиквитиновыми цепями, расщепляются с помощью 26S- протеасомы. Однако впоследствии оказалось, что система убиквитина вовлечена и в такие важные процессы, как размножение и дифференцировка клеток, реакция на стресс и патогены, репарация ДНК.
В 2004 г Аарон Чехановер, Аврам Гершко и Ирвин Роуз были удостоены Нобелевской премии по химии «за открытие убиквитин-опосредованной деградации белка».
[102] Биомолекула.ru/ Вездесущий убиквитин
А теперь немного о самих протеасомах. Есть два вида протеасом: 26S протеасомы и 20S протеасомы. 20S протеасома входит в качестве протеолитического ядра (камеры , где происходит деградация белков) в состав 26S протеасомы. 20S протеасома представляет собой полый цилиндр длиной 15-17 нм и диаметром около 11-12 нм. Он образован четырьмя лежащими друг на друге кольцами, состоящими каждое из семи белковых субъединиц, причем внешние кольца состоят из субъединиц а-типа, а внутренние - из субъединиц b-типа. Канал внутри такого цилиндра образует три камеры: большую центральную и две меньшие по краям. В центральной камере происходит протеолиз - расщепление белков на аминокислоты, а боковые камеры, за счет гидрофобности участков субъединиц а-колец, не дают белкам случайно проникнуть в протеолитическую камеру и тем самым препятствует случайному разрушению рабочих белков. Также субъединицы а-колец отвечают за присоединение к протеасоме других молекулярных комплексов, регулирующих её работу.
Маркировку белков, направляемых в протеасомы, осуществляет система убиквитинирования
[править]У млекопитающих до 90% клеточных белков (не только всех короткоживущих, но и большинства долгоживущих) подвергается гидролизу в полости протеасомы. Однако, прежде чем начнется этот процесс, она должна распознать объект протеолиза по какому-то признаку, ярлыку. Оказалось, маркировкой занимается специальная система ферментов (ее называют системой убиквитинирования). Маркером же служит цепочка не менее чем из четырех молекул белка убиквитина, состоящего из 76 аминокислотных остатков. Как образование цепочки через остаток лизина-48 в каждой молекуле, так и присоединение ее к белку-субстрату как раз и обслуживается системой ферментов. Эта система, включающая три типа ферментов (Е1, Е2 и Е3), высоко специфична и избирательна за счет того, что построена по принципу иерархического усложнения. Фермент Е1 (в клетке он только один) активирует молекулу убиквитина и передает ее одному из ферментов семейства Е2 (их называют конъюгирующими). Затем в каскад реакций вступает третий участник — представитель семейства Е3, лигаз, “сшивающих” ферментов. Он принимает убиквитин от Е2, соединяется с белком-субстратом и ковалентно пришивает к нему цепочку убиквитина. Если Е1 не имеет разновидностей, то семейство Е2 насчитывает 13 членов в клетке дрожжей Saccharomyces cerevisiae, а у млекопитающих — гораздо больше. В семействе Е3 сейчас известно около 100 разных лигаз, они-то и определяют в конечном счете высокую специфичность всей протеолитической системы.
Почему же цепочка убиквитина пришивается именно к тому белку, чья судьба предрешена? Оказывается, он уже несет признаки смерти — специфические сигналы, которые включают процесс деградации. Ими могут быть участки внутри белковой молекулы или на ее N-конце. Видимо, в определенных условиях они становятся доступными для узнавания ферментной системой, ответственной за маркировку. К основным сигналам для присоединения убиквитина могут быть отнесены следующие: • конформация N-терминальной области пептида, в частности наличие «дестабилизирующей» N-концевой или другой свободной -аминогруппы («N-концевое правило») или специфически расположенный лизин субстрата; • определенные короткие мотивы в последовательности аминокислотных остатков • нарушения вторичной и третичной структуры белка (неправильное свертывание полипептидной цепи); • повреждение боковых цепей остатков аминокислот, в том числе их окисление (например окисление остатков метионина); • избыточное гликозилирование белков и пептидов.
Некоторые N-концевые аминокислотные остатки (у эвкариот особенно часто Арг, Лиз, Лей, Фен, Асп) играют большую роль в определении жизни многих короткоживущих белков (в среднем они существуют от нескольких минут до трех часов), а также частично разрушенных белков или белков с измененной третичной структурой. В ряде случаев дестабилизирующие аминокислоты присоединяются к N-концу долгоживущих белков специфическими ферментами, после чего такие белки быстро разрушаются протеасомой.
На зависимость скорости деградации от природы N-концевых аминокислот (правило N-конца) первым обратил внимание наш бывший соотечественник А.Варшавский, он же ввел понятие “короткоживущие белки”.
Цепочка убиквитина способна присоединяться к белку-мишени и по сигналам, возникающим за счет некоторых вторичных модификаций (например, фосфорилирования) или соединения со вспомогательными белками.
Протеасома расщепляет белки на короткие пептиды,попадающие в цитоплазму
[править]Маркировка белка-субстрата (мишени) цепочкой убиквитина завершилась. Теперь ее узнает и связывается с ней одна или более субъединиц регулятора РА700. Этот процесс, как и последующее разворачивание субстрата, нуждается в энергии АТФ. Видимо, роль АТФазы выполняет тот же белок-регулятор. Развернутая, линейная молекула белка протягивается через регулятор, играющий роль рта протеасомы, и через открытое отверстие в a-кольце проникает в протеолитическую камеру. Здесь белок расщепляется на полипептиды длиной от 5 до 24 аминокислотных остатков. Они высвобождаются из протеасомы и в цитоплазме могут подвергнуться гидролизу до аминокислот протеазами (например, эндопептидазами). Часть этих полипептидов переносятся в лизосомы и затем перемещаются на поверхность клетки в комплексе с белками МНС, определяя ее антигенные свойства. Ненужная больше маркировочная цепочка из молекул убиквитина ликвидируется: изопептидазы разрывают ее на мономеры.
Работа протеасом играет важную роль в регуляции жизнедеятельности клетки
[править]Расщепление белков в протеасомах – главный механизм регуляции времени жизни короткоживущих белков. Видимо, протеасомы принимают участие и в процессах деградации белков и пептидов с аномальной структурой. Деградация короткоживущих регуляторных белков через убиквитин-протеасомный путь играет важную роль в основополагающих процессах жизнедеятельности клетки. К таким белкам, например, относятся циклины, циклин-зависимые киназы и их ингибитры, супрессоры опухолей, онкобелки, активаторы транскрипции и их ингибиторы и многие другие. Весьма детально изучена деградация циклинов – регуляторных белков, которые синтезируются и затем быстро разрушаются на различных фазах клеточного цикла, контролируя тем самым его прогрессию.
Итак, деградация белка в протеасомах:
- регулирует время жизни важнейших белков,
- удаляет из клетки чужеродные и аномальные белки,
- поставляет образовавшиеся в результате гидролиза полипептиды в качестве антигенов, способных сообщать иммунной системе о неполадках в клетке.
Таким образом, внутриклеточный протеолиз — это не механический процесс деградации белков, а один из основных факторов, которые регулируют жизнедеятельность клетки.
Клеточное ядро и клеточный цикл
[править][103] Ядро (англ.) на сайте Biology Reference
Строение ядра
[править]Ядро окружено ядерной оболочкой. Она состоит из двух элементарных мембран, между которыми находится околоядерное (перинуклеарное) пространство. Под внутренней мембраной находится состоящая из белков ядерная пластинка — ламина. Оболочка ядра пронизана ядерными порами. Внутри ядра содержится жидкая кариоплазма (аналог цитоплазмы) и хроматин — деспирализованные в период между делениями клетки хромосомы. В ядре содержатся одно или несколько ядрышек, состоящих из белков и РНК. В них происходит сборка субъединиц рибосом.
Ядерная оболочка
[править]Ядерные поры
[править]Ядерные поры — транспортные каналы, пронизывающих двухслойную ядерную оболочку. Через них происходит обмен веществами между ядром и цитоплазмой клетки. Переход молекул из ядра в цитоплазму и в обратном направлении называется ядерно-цитоплазматическим транспортом. Ядерные поры — это не просто отверстия, а сложно устроенные, регулируемые белковые комплексы.
Структура и свойства ядерных пор
Структура ядерных пор

Ядерные поры — это не просто отверстия, а сложно устроенные, многофункциональные регулируемые структуры — белковые комплексы, образованные приблизительно 30 белками — нуклеопоринами. Белковая составляющая ядерной поры обозначается термином «комплекс ядерной поры» (англ. nuclear pore complex, NPC). Масса комплекса ядерной поры колеблется в пределах от ~44 МДа в клетках дрожжей до ~125 МДа у позвоночных.
По данным электронной микроскопии, ядерные поры в поперечном сечении имеют форму «восьмиспицевого тележного колеса», то есть имеют ось симметрии восьмого порядка. Эти данные подтверждает тот факт, что молекулы нуклеопоринов присутствуют в составе ядерной поры в количестве, кратном восьми. Проницаемый для молекул канал располагается в центре структуры. Комплекс ядерной поры заякорен на ядерной оболочке с помощью трансмембранной части, от которой к просвету канала обращены структуры, получившие название спиц (англ. spokes), по аналогии со спицами тележного колеса. Эта коровая часть поры, построенная из восьми доменов, с цитоплазматической и ядерной сторон ограничена соответственно цитоплазматическим и ядерным кольцами (англ. rings; у низших эукариот они отсутствуют). К ядерному кольцу прикреплены белковые направленные внутрь ядра тяжи (ядерные филаменты, англ. filaments), к концам которых крепится терминальное кольцо (англ. terminal ring). Вся эта структура носит название ядерной корзины (англ. nuclear basket). К цитоплазматическому кольцу также прикреплены направленные в цитоплазму тяжи — цитоплазматические филаменты. В центре ядерной поры видна электронноплотная частица, «втулка» или транспортер (англ. plug).
Свойства ядерных пор
Количество ядерных пор на одно ядро у дрожжей — примерно 200, в большинстве клеток человека — 3000-5000, а в зрелых ооцитахах шпорцевой лягушки (Xenopus laevis) — до 50 млн. Этот показатель может также варьировать в зависимости от типа клетки, состояния организма и стадии клеточного цикла. Например, в клетках позвоночных количество ядерных пор удваивается на протяжении S фазы, одновременно с удвоением хромосом. При разборке ядерной оболочки во время митоза ядерные поры позвоночных распадаются на субкомплексы с массами около миллиона дальтон. Показано, что разборка комплекса ядерной поры инициируется циклин B-зависимой киназой, фосфорилирующей нуклеопорины. После завершения клеточного деления ядерные поры собираются заново. Ядерные поры интерфазного ядра перемещаются по мембране большими массивами, а не независимо друг от друга, причем эти перемещения происходят синхронно с перемещениями ядерной ламины. Это служит доказательством того, что ядерные поры механически связаны между собой и формируют единую систему — сеть (англ. NPC network).
Транспорт веществ через ядерные поры
[править]
Ядерно-цитоплазматический транспорт можно разделить на две категории: активный транспорт, требующий затрат энергии, а также специальных белков-рецепторов, и пассивный транспорт, протекающий путем простой диффузии молекул через канал ядерной поры.
Пассивный транспорт
Молекулы небольших размеров (ионы, метаболиты, мононуклеотиды и т. д.) способны пассивно диффундировать в ядро. Проводимость ядерных пор для молекул разных размеров различна. Белки массой до 15 кДа быстро проникают в ядро, в то время как для белка массой более 30 кДа на это требуется определенное время. Белковые молекулы массой более 60-70 кДа, по-видимому, вообще не могут пассивно проходить через ядерные поры. Впрочем, пропускная способность ядерных пор для пассивной диффузии может изменяться в зависимости от типа клетки и стадии клеточного цикла.
Активный транспорт
Путём активного транспорта через ядерные поры могут проходить гораздо более крупные молекулы и целые надмолекулярные комплексы. Так, рибосомные субъединицы размерами до нескольких мегадальтон транспортируются из ядра в цитоплазму через ядерные поры, и нет никаких оснований предполагать, что процесс транспорта сопровождается частичной разборкой этих субъединиц. Молекулы РНК, синтезируемые в ядре, поступают через поры в цитоплазму, а в ядро попадают белки, участвующие в ядерном метаболизме. Причем одни белки должны поступать в ядро конститутивно (например, гистоны), а другие в ответ на определенные стимулы (например, транскрипционные факторы).
У ядерных белков идентифицированы специальные сигнальные последовательности, отвечающие за их локализацию. Самая распространенная из них, так называемый «классический» сигнал ядерной локализации — NLS (от англ., Nuclear Localization Signal), представляет собой один или два участка, состоящих из положительно заряженных аминокислот, аргинина и лизина. Транслокация белков в ядро, в отличие от транслокации в митохондрии и ЭПС, не сопровождается отщеплением этой сигнальной последовательности и разворачиванием полипептидной цепи. NLS-содержащие белки, как и все другие субстраты систем ядерного транспорта, переносятся в ядро в комплексе со специальными белками — транспортинами, или кариоферинами (англ. transportins, karyopherins).
Каждый транспортин или комплекс транспортинов для осуществления своей функции должен обладать тремя активностями: во-первых, он должен узнавать и связывать транспортируемый субстрат, во-вторых, заякориваться на ядерной поре, и в-третьих, связывать небольшой белок — GTPазу Ran, относящуюся к семейству Ras-подобных ГТФаз и служащую для сопряжения транспорта с гидролизом ГТФ, что придает процессу необратимость (снабжает его энергией). Собственно акт гидролиза ГТФ осуществляется непосредственно этим белком. Фактор обмена нуклеотидов (англ. GTPase Еxchange Factor, GEF) для Ran — хроматин-связывающй белок RCC1 — локализован строго в ядре, а активаторы ГТФазной активности (англ., GTPase Activation Protein, GAP) RanGAP1 и некоторые другие белки — строго в цитоплазме. Эта асимметричная локализация приводит к формированию градиента: в ядре находится преимущественно ГТФ-связанная форма Ran, в цитоплазме, наоборот, ГДФ-связанная. Ran используется для снабжения энергией как процессов импорта, так и процессов экспорта различных субстратов, а вся схема носит название Ran-цикла (англ., Ran-cycle). Ran-цикл снабжает энергией и экспорт, и импорт, используя общий принципиальный механизм, ключевыми стадиями которого являются гидролиз ГТФ в цитоплазме и обмен ГДФ на ГТФ в ядре.
Механизм импорта белков в ядро
Рассмотрим механизм поступления субстратов в ядро на примере импорта NLS-содержащих белков. Первой стадией транспортировки является узнавание субстрата транспортинами, в данном случае комплексом импортинов-α/β (транспортины, участвующие в транспорте в ядро называются импортинами, а из ядра — экспортинами). Затем образовавшийся комплекс заякоривается на белках ядерной поры с цитоплазматической стороны и транслоцируется через канал в ядро, где с ним связывается Ran-ГТФ, что вызывает диссоциацию комплекса и высвобождение груза. После этого импортины в комплексе с Ran-ГТФ направляются обратно в цитоплазму, где Ran под действием RanGAP1 гидролизует ГТФ (ГТФ => ГДФ + PO43-). Комплекс Ran-ГДФ-импортины α/β нестабилен и диссоциирует. Ran-ГДФ поступает обратно в ядро при помощи собственного переносчика, белка NTF2. В ядре под действием белка RanGEF ГДФ в активном центре Ran заменяется на ГТФ, и цикл, тем самым, замыкается.
Механизм экспорта белков из ядра
Теперь рассмотрим механизм экспорта из ядра на примере белков, содержащих сигналы ядерного экспорта (англ., Nuclear Export Signal, NES). Для этой сигнальной последовательности характерно выскокое содержание гидрофобных аминокислот. Первой стадией транспортировки здесь также является рецепция субстрата специфическим экспортином Crm1 (англ., Chromosome Region Maintenance) и образование комплекса. Главным отличием механизмов экспорта является тот факт, что в состав транслоцирующегося комплекса в случае экспорта помимо субстрата и Crm1 входит и Ran-ГТФ, то есть сопряжение с циклом Ran происходит на стадии транслокации, а не на стадии реимпорта рецептора. После прохождения через ядерную пору в цитоплазму Ran расщепляет ГТФ, комплекс теряет стабильность и диссоциирует, высвобождая груз.
Хроматин
[править]Хроматин — это вещество хромосом: комплекс ДНК, РНК и белков. Хроматин находится внутри ядра клеток эукариот и входит в состав нуклеоида у прокариот. ДНК в клетке всегда входит в состав хроматина, поэтому именно в составе хроматина происходит реализация генетической информации, а также репликация и репарация ДНК.
Основную массу хроматина составляют белки гистоны. Гистоны являются компонентом нуклеосом, — надмолекулярных структур, участвующих в упаковке хромосом. Нуклеосомы располагаются довольно регулярно, так что образующаяся структура напоминает бусы. Нуклеосома состоит из белков-гистонов четырех типов: H2A, H2B, H3 и H4. В одну нуклеосому входят по два белка каждого типа — всего восемь молекул. Гистон H1, более крупный, чем другие гистоны, связывается с ДНК в месте ее входа на нуклеосому.
Нить ДНК с нуклеосомами образует нерегулярную соленоид-подобную структуру толщиной около 30 нанометров, так называемую 30 нм фибриллу. Дальнейшие уровни упаковки хроматина изучены гораздо хуже.
Упаковка хроматина может иметь различную плотность. Если хроматин упакован плотно, его называют конденсированным или гетерохроматином, он хорошо видим под микроскопом. ДНК, находящаяся в составе гетерохроматина, не транскрибируется, обычно это состояние характерно для незначащих (не кодирующих белки) или молчащих участков. В интерфазе гетерохроматин обычно располагается по периферии ядра (пристеночный гетерохроматин). Полная конденсация хромосом происходит у большинства эукариот перед делением клетки. Если хроматин упакован неплотно, его называют эухроматин. Этот вид хроматина обычно характеризуется наличием транскрипционной активности. Плотность упаковки хроматина во многом определяется модификациями гистонов — ацетилированием и фосфорилированием
Считается, что в ядре существуют так называемые функциональные домены хроматина (ДНК одного домена содержит приблизительно 30 тысяч пар оснований), то есть каждый участок хромосомы имеет собственную «территорию». Вопрос пространственного распределения хроматина в ядре изучен пока недостаточно. Известно, что теломерные (концевые) и центромерные (отвечающие за связывание сестринских хроматид в митозе) участки хромосом закреплены на белках ядерной ламины.
Длины метафазных хромосом человека на цитологических препаратах лежат в пределах 1-10 мкм. Однако, по данным новых исследований, в клетке хромосомы имеют иную форму, а при приготовлении препаратов в результате фиксации и окраски сильно вытягиваются.
[104]Хромосома человека в четырех измерениях. Н. Б. Рубцов/Природа, 2007, N 8
Ядрышко
[править]Ядерный матрикс
[править]Я́дерный скеле́т, или ядерный матрикс (англ. nuclear matrix) — опорная структура ядра клетки, составленная периферической пластинкой (ламиной) и пронизывающими ядро тяжами. В настоящий момент функция ядерного скелета окончательно не выяснена.
Считается, что матрикс построен преимущественно из негистоновых белков, формирущих сложную развлетвленную сеть, сообщающуюся с ядерной ламиной. Возможно, ядерный матрикс принимает участие в формировании функциональных доменов хроматина. В геноме эукариот имеются специальные незначащие А-Т-богатые участки прикрепления к ядерному матриксу (англ. S/MAR — Matrix/Scaffold Attachment Regions), служащие, как предполагается, для заякоривания петель хроматина на белках ядерного матрикса. Впрочем, не все исследователи признают существование ядерного матрикса в виде прочной, относительно стабильной сети фибриллярных белков, подобной цитоскелету цитоплазмы эукариот.
Доказательства роли ядра в наследственности
[править]Опыты по удалению и пересадке ядер
[править]Еще в конце XIX века были проведены первые опыты по удалению ядер и отдельных хромосом.

Клонирование растений и животных
[править]Хромосомы — структура и функции
[править]Хромосо́мы — нуклеопротеидные структуры в ядре эукариотической клетки, в которых сосредоточена большая часть наследственной информации и которые предназначены для её хранения, реализации и передачи. У большинства эукариот хромосомы чётко различимы в световом микроскопе только в период митотического или мейотического деления клетки. В течение интерфазы они обычно деспирализуются; но у динофлагеллят и некоторых других протистов хромосомы остаются спирализованными и в период интерфазы, а, например, у малярийного плазмодия остаются деспирализованными и во время деления клетки. Набор всех хромосом клетки, называемый кариотипом, является видоспецифичным признаком, для которого характерен относительно низкий уровень индивидуальной изменчивости.
Ядрышковый организатор и ядрышко
[править]От чего зависит количество ядрышек в клетке?
Хромосомные территории и их роль в регуляции работы генов
[править]Клеточный цикл
[править]Основные фазы клеточного цикла
[править]Механизмы регуляции клеточного цикла
[править]Апоптоз и механизмы его регуляции
[править]- [105]- В. Д. Самуилов. Биохимия программируемой клеточной смерти (апоптоза) у животных. — СОЖ, 2001, т.7, N 10, c. 18-25
- [106]- Подробное изложение механизмов апоптоза с иллюстрациями
- [107] — Апоптоз (сайт «Биология человека»)
- [108] — Апоптоз у диктиостелиума (англ.)
Деление клетки
[править]Механизмы деления клетки у прокариот
[править]Митоз и мейоз — способы деления клеток эукариот. Роль митоза и мейоза в жизненном цикле
[править]Митоз — способ деления клеток эукариот, при котором каждая дочерняя клетка получает то же число (и тот же набор) хромосом, что и материнская. Митозом могут делиться как гаплоидные, так и диплоидные клетки. При митозе клетки-потомки созраняют плоидность, которую имела материнская клетка: n → n, 2n → 2n.
Мейоз— способ деления клеток эукариот, при котором каждая дочерняя клетка получает в 2 раза меньшее число хромосом, чем материнская. При мейозе из диплоидных клеток получаются гаплоидные: 2n → n
Митоз, его роль в размножении и развитии эукариот. Фазы митоза
[править]Митоз — способ деления клеток эукариот, при котором каждая дочерняя клетка получает то же число (и тот же набор) хромосом, что и материнская.
Митозом могут делиться как гаплоидные, так и диплоидные клетки.
- [109] Видео митоза в растительной клетке (клетка лилии)
- [110] Видео митоза в животной клетке (клетка яичника китайского хомячка)
Разнообразие типов митоза у эукариот
[править]Мейоз. Фазы мейоза
[править]Мейоз — это способ деления клеток эукариот, при котором из одной материнской клетки с двойным набором хромосом получается четыре с одинарным (если у материнской диплоидный набор, то у получившихся — гаплоидный). Мейоз включает в себя два деления:
- Редукционное деление, в ходе которого к полюсам клетки расходятся гомологичные хромосомы, состоящие из пары хроматид. В результате образуется две новых клетки с гаплоидным набором.
- Эквационное деление, в ходе которого обе образовавшиеся клетки делятся так же, как при митозе.
Перед редукционным делением ДНК реплицируется (удваивается). Между редукционным и эквационным делениями удвоения ДНК не происходит.
- Редукционное деление разбивают на четыре фазы:
- Профаза I: образуется веретено деления, ядерная оболочка разрушается, а гомологичные хромосомы объединяются в биваленты (соединившиеся пары гомологичных хромосом). В это время пара хроматид из разных хромосом одного бивалента может обмениваться участками, которые содержат гомологичные последовательности ДНК (одинаковые или разные аллели одного гена). Такой процесс называется кроссинговером.
- Метафаза I: во время этой фазы биваленты выстраиваются по экватору клетки, а нити веретена (микротрубочки) прикрепляются к центромерам разных гомологичных хромосом из пары. К каждой хромосоме присоединяются микротрубочки только от одного полюса веретена деления.
- Анафаза I: гомологичные хромосомы каждой пары растягиваются к разным полюсам клетки. В результате образуются две клетки с гаплоидным набором хромосом.
- Телофаза I: снова строится ядерная оболочка, и хромосомы раскручиваются (деспирализуются).
- Эквационное деление тоже делится на четыре фазы.
- Профаза II: в образовавшихся при редукционным делении клетках хромосомы конденсируются, образуется веретено деления, и нити от обоих полюсов веретена присоединяются к центромерам каждой хромосомы.
- Метафаза II: хромосомы выстраиваются вдоль экватора клетки, образуя метафазную пластинку.
- Анафаза II: центромера каждой хромосомы делится пополам, и нити веретена растягивают половинки хромосом (хроматиды) к разным полюсам каждой клетки.
- Телофаза II почти ничем не отличается от телофазы I.
Передача сигнала в клетках
[править]Передача сигналов от поверхности внутрь клетки необходима для функционирования любого организма. С помощью передачи сигналов клетки могут реагировать на изменения внеклеточный среды. У многоклеточных организмов с помощью передачи сигнала клетки реагируют на действие гормонов, нейромедиаторов и других сигнальных веществ, а также на другие стимулы (кроме химических). Например, многие клетки могут влиять друг на друга с помощью передачи механических или электрических стимулов, а клетки-рецепторы с помощью механизмов передачи сигналов воспринимают все раздражители (свет, запах, вкус. прикосновение и т.п.) и в конечном счете преобразуют их в нервные импульсы, передающиеся в мозг. Изучение механизмов передачи и усиления сигналов является одной из основных задач биологии клетки. Их знание необходимо для понимания механизмов формирования функционального ответа клеток в норме, его регуляции и коррекции при патологических состояниях.
Типы межклеточной сигнализации
[править]Сейчас известно множество способов межклеточной сигнализации, которые можно классифицировать по-разному - например, по природе передаваемого сигнала.
Чаще всего сигналом служат растворенные во внеклеточной жидкости химические вещества.
Межклеточную сигнализацию с помощью таких веществ часто подразделяют на три основных типов - аутокринную, паракринную и эндокринную.
Аутокринная сигнализация - клетки отвечают на вещества, вырабатываемые этими же клетками.
Паракринная сигнализация - сигнализирующие клетки влияют на рядом расположенные клетки
Дистантная сигнализация(эндокринная сигнализация)- при этом гормон или действуют на клетки-мишени вдалеке от места его выработки; у человека гомрон (сигнальное вещество) в таких случаях переносится кровью.
Принципы внутриклеточной передачи сигнала
[править]Путь передачи сигнала заключается в цепочке взаимодействий
-сигнальная молекула(лиганда)
-рецептор на поверхности клетки или внутри нее
-внутриклеточный усилительный механизм
-клеточный ответ - изменение активности белков или включение определенных специфичных для данного сигнала генов.
Клеточный рецептор — молекула (обычно белок) на поверхности клетки, клеточных органелл или растворенная в цитоплазме, специфически реагирующая изменением своей пространственной конфигурации на присоединение к ней молекулы определенного химического вещества, передающего внешний регуляторный сигнал и, в свою очередь, передающая этот сигнал внутрь клетки или клеточной органеллы, нередко при помощи так называемых вторичных посредников или трансмембранных ионных токов. Вещество, специфически соединяющееся с рецептором, называется лигандом этого рецептора.
В настоящее время известно около 50 белков-лигандов и 14 семейств рецепторов. Лигандами служат и многочисленные вещества небелковой природы.
Основные типы белков-рецепторов
[править]Клеточные рецепторы можно разделить на два основных класса - мембранные рецепторы и внутриклеточные рецепторы.
Основные типы мембранных рецепторов:
- Ионотропные рецепторы - по существу они представляют собой ионные каналы. При действии на них лиганда они открываются или закрываются, в результате чего меняются внутриклеточные концентрации ионов и мембранный потенциал клетки.
- Метаботропные рецепторы - по существу они являются ферментами, так как передают сигнал, запуская какую-нибудь химическую реакцию.
- Рецепторы, связанные с гетеротримерными G-белками (например, рецептор вазопрессина).
- Рецепторы, обладающие внутренней тирозинкиназной активностью (например, рецептор инсулина).
Основные типы внутриклеточных рецепторов:
- Внутриклеточными рецепторами чаще всего служат белки, которые, связываясь с лигандом, выполняют роль транскрипционных факторов.
Ионотропные и метаботропные рецепторы
[править]Ионотропные рецепторы представляют собой мембранные каналы, открываемые или закрываемые при связывании с лигандом. Возникающие при этом ионные токи вызывают изменения трансмембранной разности потенциалов и, вследствие этого, возбудимости клетки, а также меняют внутриклеточные концентрации ионов, что может вторично приводить к активации систем внутриклеточных посредников. Одним из наиболее полно изученных ионотропных рецепторов является н-холинорецептор.
Метаботропные рецепторы связаны с системами внутриклеточных посредников. Изменения их конформации при связывании с лигандом приводит к запуску каскада биохимических реакций, и, в конечном счете, изменению функционального состояния клетки
Никотиновый ацетилхолиновый рецептор: пример ионотропного рецептора
[править]Данный рецептор найден в химических синапсах как в центральной, так и в периферической нервной системе, в нервно-мышечных синапсах, а также в эпителиальных клетках многих видов животных.
Никотиновые рецепторы являются членами суперсемейства мембранных белков, включающих рецепторы серотонина (5-гидрокситриптамин, 5-НТ) , рецепторы для глицина и рецепторы ГАМК (гамма-аминомасляной кислоты).
Было доказано, что данный рецептор в нервно-мышечных синапсах (где он расположен на мембранах клеток скелетных мышц) является гетероолигомерным комплексом, состоящим из четырех разных белковых субъединиц, которые были названы соответственно их молекулярной массе (в килодальтонах): α (40), β (50), γ (60), δ (65). При естественной экспрессии в клетке сначала возникают димерные комплексы α-γ и α-δ, потом формируется тример α-β-δ, и наконец, после объединения димера и тримера, в клеточную мембрану встраивается функциональный пентамер со стехиометрией α2βγδ.
Итак, белок-рецептор ацетилхолина состоит из пяти субъединиц, которые вместе образуют канал, пронизывающий клеточную мембрану. Каждый из таких каналов может находиться в двух состояниях – открытом или закрытом. В открытом состоянии каналы проницаемы для строго определенных ионов (В основном ионов натрия и в меньшей степени - ионов калия). Большую часть времени этот канал закрыт. Но если две молекулы ацетилхолина связываются с белком, то заряд внутри макромолекулы сдвигается и, как следствие, происходит аллостерическое изменение его формы. Центральный канал расширяется, его внутренний диаметр становится приблизительно равным 0,65 нм. Благодаря этому он становится проходимым для катионов Na+ и K+. Для анионов канал остается непроходимым из-за имеющихся на внутренней стенке зарядов.
Другие ионотропные рецепторы
[править]На многих клетках (в том числе нейронов) есть и множество других типов ионотропных рецепторов. Так, рецепторы некоторых тормозных нейромедиаторов - например, глицина - это хлорные каналы. Некоторые типы рецепторов глутамата (NMDA-рецепторы) проницаемы не только для ионов калия и натрия, но и для ионов кальция.
Основные системы внутриклеточной передачи сигнала от метаботропных рецепторов: вторичные посредники
[править]- Аденилатциклазная система. Центральной частью аденилатциклазной системы является фермент аденилатциклаза, который катализирует превращение АТФ в цАМФ(циклического аденозинмонофосфата). Этот фермент может либо стимулироваться Gs-белком (от английского stimulating), либо подавляться Gi-белком (от английского inhibiting). цАМФ после этого связывается с цФМФ-зависимой протеинкиназой, называемой также протеинкиназа А, PKA. Это приводит к ее активации и последующему фосфорилированию белков-эффекторов, выполняющих какую-то физиологическую роль в клетке.
- Фосфолипазно-кальциевая система. Gq-белки активируют фермент фосфолипазу С , которая расщепляет PIP2 (мембранный фосфоинозитол) на две молекулы: инозитол-3-фосфат (IP3) и диацилглицерол. Каждая из этих молекул является вторичным посредником. IP3 далее связывается со своими рецепторами (кальциевыми каналами) на мембране эндоплазматического ретикулума, что приводит к высвобождению ионов кальция в цитоплазму и запуску многих клеточных реакций.
- Гуанилатциклазная система. Центральной молекулой данной системы является гуанилатциклаза, которая катализирует превращение ГТФ в цГМФ. цГМФ модулирует активность ряда ферментов и ионных каналов. Существует несколько изоформ гуанилатциклазы. Одна из них активируется оксидом азота NO, другая непосредственно связана с рецептором предсердного натрийуретического фактора.
Мембранные рецепторы, сопряженные с G-белками
[править]Бета-2 адренорецептор и распад гликогена: пример передачи сигнала
[править]
При стрессе из мозгового слоя надпочечников в кровь выделяется гормон адреналин. Наряду с прочими изменениями в организме он вызывает распад гликогена и выброс глюкозы в кровь, действуя на клетки печени. Как же происходит передача сигнала в клетках печени?
На наружной мембране клеток печени находится β2-адренорецептор, который активируется при взаимодействии с адреналином. Этот рецептор относится к большой группе рецепторов, сопряженных с G- белками — G-protein coupled receptors. К внутренней стороне наружной мембраны клеток печени прикреплены Gs-белки, состоящий из 3 субъединиц: α, β и γ. Взаимодействуя с β2-рецептором, G-белок распадается на α-субъединицу и β-γ субъединицу. α-субъединица обменивает прикрепленную к ней ГДФ на ГТФ, вследствие чего она активируется и взаимодействует с мембранным ферментом аденилатциклазой. Аденилатциклаза в свою очередь активируется и катализирует образование цАМФ (циклического аденозинмонофосфата) из АТФ. цАМФ служит для передачи сигнала во многих внутриклеточных процессах; это один из универсальных вторичных мессенджеров (посредников).

цАМФ диффундирует в цитоплазме и активирует протеинкиназу А. При присоединении 4-х молекул цАМФ протеинкиназа А распадается на 4 субъединицы: 2 активные и 2 неактивные. цАМФ присоединяется к регуляторным субъединицам (по 2 молекулы цАМФ к каждой субъединице). Активные каталитические субъединицы, расщепляя АТФ на АДФ и фосфат(PO43-), фосфорилируют киназу фосфорилазы (то есть присоединяют к ней фосфат). Киназа фосфорилазы в свою очередь активируется и фосфорилирует фосфорилазу. Фосфорилаза осуществляет фосфоролиз гликогена, вследствие чего он расщепляется до глюкозо-6-фосфата.
Затем глюкозо-6-фосфат преобразуется в глюкозу, которая выходит из клеток печени в кровь.
Чтобы остановить распад гликогена, необходимо вывести из организма адреналин (например, с помощью выделительной системы). Из-за инактивации β2-рецептора он перестает взаимодействовать с G-белком. α-субъединица G-белка расщепляет прикрепленную к ней ГТФ на ГДФ и фосфат, вследствие чего субъединицы G-белка объединяются и инактивируются. Аденилатциклаза так же инактивируется, так как она перестает взаимодействовать с G-белком, следовательно, останавливается образование цАМФ. Оставшийся в клетке цАМФ расщепляется ферментом фосфодиэстеразой, протеинкиназа А собирается и инактивируется. Фосфатные группы отсоединяются от киназы фосфорилазы и фосфорилазы ферментами фосфатазами.
Воздействие адреналина на β2-рецептор дает начало реакции, проходящей с каскадным эффектом, то есть усиливающейся на каждом этапе. Небольшое количество гормона (в данном случае адреналина) вызывает существенные изменения в клетке, так как сигнал доходит до своей конечной цели уже многократно усиленным (возможно, более чем в несколько десятков тысяч раз).
G-белок при взаимодействии с β2 адренорецептором (англ.) Образование цАМФ и его действие на протеинкиназу А (англ.)
Другие пути передачи сигнала от рецепторов, связанных с G-белками
[править]- [111] Анимация «Влияние адреналина на активность генов в клетках печени» (англ. текст)
К рецепторам, сопряженным с G-белками, относятся все адренорецепоры и многие другие типы рецепторов - например, мускариновые холинорецепторы. При этом с разными рецепторами взаимодействуют разные типы G-белков - иногда с прямо противоположным действием на следующие звенья цепи передачи сигнала. Выделяют четыре основных группы G-белков: Gs, Gi, Gq, and G12/13.
Рецепторы с протеинкиназной актиностью
[править]Цитоплазматические (ядерные) рецепторы
[править]Передача сигнала и обмен веществ
[править]Передача сигнала и клеточный цикл
[править]Передача сигнала и ориентация в пространстве
[править]Другие аспекты межклеточной сигнализации
[править]Часть 2. Клетки в многоклеточном организме
[править]Клетка — основа размножения и развития
[править]Биология развития и её основные проблемы
[править]Полезные сайты по теме:
[112] — 8e.devbio.com (С.Гилберт, англ.)
Развитие одноклеточных
[править]Развитие колониальных организмов. Вольвокс
[править]Развитие колониальных организмов. Диктиостелиум
[править]Общие черты развития животных. Жизненный цикл животных
[править][113]Р.Рэфф, Т. Кофмен. Эмбрионы, гены и эволюция.
Гаметогенез
[править]Оплодотворение
[править]Дробление
[править]Первый этап развития всех животных из яйцеклетки — дробление. В ходе дробления яйцеклетка делится на более мелкие клетки — бластомеры. Митотические деления разных всех бластомеров часто синхронизированы, так что число клеток меняется как ряд 2, 4, 8, 16...(Нередко, однако, синхронизация нарушается уже при втором делении). Образующиеся при дроблении бластомеры нередко детерминированы (их дальнейшая судьба предопределена, из каждого при нормальном развитии возникнут определенные ткани и органы), но обычно не имеют признаков тканевой дифференцировки (признаков нервных. мышечных и т.п. клеток). У большинства животных дробление заканчивается образованием однослойного зародыша — бластулы.
В ходе дробления (часто до его окончания, но иногда лишь на первых этапах) собственный геном зародыша не активен. Белки синтезируются с иРНК, запасённых в цитоплазме яйцеклетки. Вот почему дробление обычно идёт по материнскому типу, а для многих признаков, определяемых в ходе дробления, характерно материнское наследование.
Гаструляция
[править]Органогенез
[править]Рост и регенерация
[править]Старение и смерть
[править]Механизмы развития животных
[править]Дифференцировка клеток и морфогенез
[править]Дифференцировка клеток и её генетическая регуляция
[править]Достижения в регуляции дифференцировки методами молекулярной биологии
[править]Генетическая регуляция морфогенеза
[править]Зачем нужны модельные организмы
[править]- [114]- Краткий справочник и система поиска информации по модельным организмам (англ.)
Генетика развития нематоды
[править]Генетика развития дрозофилы
[править]Генетика развития лягушки
[править]Генетика развития мыши
[править]Общие выводы
[править]Взаимодействия клеток и развитие организма
[править]Особенности развития цветковых растений
[править]Жизненный цикл цветковых
[править]Особенности развития спорофита цветковых
[править]Генетическая регуляция развития у цветковых
[править]Клетки и ткани
[править]Строение и развитие нервной системы
[править]Иммунитет и развитие иммунной системы
[править]- Полезные сайты по теме
- Полезные статьи по теме
- Новый этап развития иммунологии/К. А. Лебедев, И. Д. Понякина /Природа, 2006, N4
Некоторые прикладные аспекты клеточной биологии
[править]Клеточная инженерия и генетическая инженерия
[править]Получение и использование биологически активных веществ
[править]Получение и использование ГМО
[править]Получение и использование стволовых клеток
[править]Клетки и рак
[править]Примечания
[править]- ↑ http://elementy.ru/news/430872
- ↑ http://www.sciencemag.org/cgi/content/abstract/322/5899/275
- ↑ Desulforudis audaxviator
- ↑ Chemical ecology
- ↑ Metagenomics
- ↑ Champoux JJ (2001). «DNA topoisomerases: structure, function, and mechanism». Annu. Rev. Biochem. 70: 369–413. DOI:10.1146/annurev.biochem.70.1.369. PMID 11395412.
- ↑ Альбертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. Молекулярная биология клетки: в трех томах. — 2. — Москва: Мир, 1994. — Т. 1. — 517 с. — 10000 экз. — ISBN 5030019855
- ↑ Жимулев И. Ф. Общая молекулярная генетика. — 1. — Новосибирск: Издательство Новосибирского университета, 2002. — 459 с. — 2000 экз. — ISBN 5761505096
- ↑ Porter KR, Claude A, Fullam EF (March 1945). «A study of tissue culture cells by electron microscopy». J Exp Med. 81 (3): 233–246. DOI:10.1084/jem.81.3.233. PMID 19871454.
- ↑ Лузиков В. Н. Экзоцитоз белков (курс лекций). М.: ИКЦ «Академкнига», 2006, 253 с.








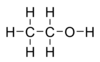
![{\displaystyle {\mbox{pH}}=-\lg \left[{\mbox{H}}^{+}\right]\!}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3558eca3199fd3c865df01330597f9d3e960b805)